TOP 15 câu Trắc nghiệm Cấu trúc lớp vỏ electron nguyên tử (Kết nối tri thức 2024) có đáp án - Hóa học 10
Bộ 15 bài tập trắc nghiệm Hóa học lớp 10 Bài 3: Cấu trúc lớp vỏ electron nguyên tử có đáp án đầy đủ các mức độ sách Kết nối tri thức giúp học sinh ôn luyện trắc nghiệm Hóa học 10 Bài 3.
Chỉ 150k mua trọn bộ Trắc nghiệm Hóa lớp 10 Kết nối tri thức bản word (cả năm) có đáp án chi tiết:
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận tài liệu.
Xem thử tài liệu tại đây: Link tài liệu
Trắc nghiệm Hóa học 10 Bài 3: Cấu trúc lớp vỏ electron nguyên tử - Kết nối tri thức
Câu 1. Theo mô hình hiện đại, trong nguyên tử, electron chuyển động như thế nào?
A. Electron chuyển động rất nhanh, theo một quỹ đạo xác định.
B. Electron chuyển động rất nhanh, không theo quỹ đạo xác định.
C. Electron chuyển động rất chậm, không theo quỹ đạo xác định.
D. Electron chuyển động rất chậm, theo một quỹ đạo xác định.
Đáp án: B
Giải thích:
Theo mô hình hiện đại, trong nguyên tử, electron chuyển động rất nhanh, không theo quỹ đạo xác định.
Câu 2. Vùng không gian xung quanh hạt nhân tìm thấy electron có thể hình dung như một đám mây electron, được gọi là
A. phân lớp electron.
B. cấu hình electron.
C. orbital nguyên tử.
D. lớp vỏ electron.
Đáp án: C
Giải thích:
Vùng không gian xung quanh hạt nhân tìm thấy electron có thể hình dung như một đám mây electron, được gọi là orbital nguyên tử.
Câu 3. Orbital nguyên tử được kí hiệu là
A. AO.
B. SO.
C. CO.
D. AS.
Đáp án: A
Giải thích:
Orbital nguyên tử được kí hiệu là AO (Atomic Orbital).
Câu 4. Các orbital trong nguyên tử được phân loại dựa trên
A. sự khác nhau về xác xuất tìm thấy electron ở mỗi vị trí xung quanh hạt nhân.
B. sự khác nhau về số electron ở mỗi lớp.
C. sự khác nhau về mức năng lượng của các electron.
D. sự khác nhau về hình dạng và sự định hướng của orbital trong nguyên tử.
Đáp án: D
Giải thích:
Dựa trên sự khác nhau về hình dạng, sự định hướng của orbital trong nguyên tử để phân loại orbital thành orbital s, orbital p, orbital d và orbital f.
Câu 5. Phát biểu nào sau đây là đúng?
A. Các orbital s có dạng hình cầu và orbital p có dạng hình số 8 nổi.
B. Các orbital s có dạng hình số 8 nổi và orbital p có dạng hình cầu.
C. Các orbital s có dạng hình bầu dục và orbital p có dạng hình số 8 nổi.
D. Các orbital s có dạng hình số 8 nổi và orbital p có dạng hình bầu dục.
Đáp án: A
Giải thích:
Các orbital s có dạng hình cầu và orbital p có dạng hình số 8 nổi.
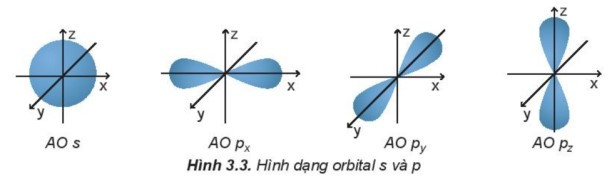
Câu 6. Theo nguyên lí loại trừ Pauli (Pau-li), trong 1 orbital chỉ chứa tối đa
A. 3 electron có chiều tự quay giống nhau.
B. 3 electron, trong đó có 2 electronc có chiều tự quay giống nhau.
C. 2 electron có chiều tự quay ngược nhau.
D. 2 electron có chiều tự quay giống nhau.
Đáp án: C
Giải thích:
Theo nguyên lí loại trừ Pauli (Pau-li), trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau.
Câu 7. Phát biểu nào sau đây không đúng?
A. Trong nguyên tử, các electron sắp xếp thành từng lớp và phân lớp theo các mức năng lượng từ thấp đến cao.
B. Những electron ở lớp gần hạt nhân bị hút mạnh hơn về phía hạt nhân, vì thế có năng lượng thấp hơn so với những electron ở lớp xa hạt nhân.
C. Các electron thuộc cùng một lớp có mức năng lượng gần bằng nhau.
D. Lớp electron thứ ba (n = 3) kí hiệu là L.
Đáp án: D
Giải thích:
Số thứ tự lớp từ trong ra ngoài và được biểu thị bằng các số nguyên n = 1, 2, 3, …, 7 với tên gọi là các chữ cái in hoa như sau:
|
n |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Tên lớp |
K |
L |
M |
N |
O |
P |
Q |
® Phát biểu không đúng là: Lớp electron thứ ba (n = 3) kí hiệu là L.
Câu 8. Các electron trên cùng một phân lớp có mức năng lượng
A. bằng nhau.
B. gần bằng nhau.
C. khác nhau và sắp xếp theo mức năng lượng từ cao đến thấp.
D. khác nhau và sắp xếp theo mức năng lượng từ thấp đến cao.
Đáp án: A
Giải thích:
Các phân lớp trong mỗi lớp electron được kí hiệu bằng các chữ cái thường, theo thứ tự: s, p, d, f.
Các electron trên cùng một phân lớp có mức năng lượng bằng nhau.
Câu 9. Lớp electron thứ hai có
A. một phân lớp, được kí hiệu là 1s.
B. có 2 phân lớp, được kí hiệu là 2s và 2p.
C. có 3 phân lớp, được kí hiệu là 3s, 3p và 3d.
D. có 4 phân lớp, được kí hiệu là 4s, 4p, 4d và 4f.
Đáp án: B
Giải thích:
Số phân lớp trong mỗi lớp bằng số thứ tự của lớp (n ≤ 4):
Lớp thứ nhất (lớp K, với n = 1) có một phân lớp, được kí hiệu là 1s.
Lớp thứ hai (lớp L, với n = 2) có hai phân lớp, được kí hiệu là 2s và 2p.
Lớp thứ ba (lớp M, với n = 3) có ba phân lớp, được kí hiệu là 3s, 3p và 3d.
Lớp thứ tư (lớp N, với n = 4) có bốn phân lớp, được kí hiệu là 4s, 4p, 4d và 4f.
Câu 10. Tổng số electron tối đa chứa trong phân lớp p là
A. 2.
B. 6.
C. 10.
D. 14.
Đáp án: B
Giải thích:
Trong 1 orbital chỉ chứa tối đa 2 electron.
Phân lớp s có 1 AO → Số electron tối đa trong phân lớp s là: 1×2 = 2.
Phân lớp p có 3 AO → Số electron tối đa trong phân lớp p là: 3×2 = 6.
Phân lớp d có 5 AO→ Số electron tối đa trong phân lớp d là: 5×2 = 10.
Phân lớp f có 7 AO →Số electron tối đa trong phân lớp f là: 7×2 = 14.
Câu 11. Lớp electron có số electron tối đa gọi là lớp electron bão hòa. Tổng số electron tối đa trong lớp M là
A. 2.
B. 8.
C. 18.
D. 24.
Đáp án: C
Giải thích:
Trong lớp electron thứ n có n2 AO (n ≤ 4).
Lớp M (n = 3) có ba phân lớp 3s, 3p và 3d, có n2 = 32 = 9 AO.
Trong 1 orbital chỉ chứa tối đa 2 electron.
→ Tổng số electron tối đa trong lớp M là: 9×2 = 18 (electron).
Chú ý: Số electron tối đa trong lớp n là 2n2 (n ≤ 4).
Câu 12. Viết cấu hình electron của nguyên tử fluorine (Z = 9).
A. 1s22s22p5.
B. 1s22s22p3.
C. 1s22s22p63s1.
D. 1s22s22p63s2.
Đáp án: A
Giải thích:
Nguyên tử fluorine (F) có: số hiệu nguyên tử Z = 9 = Số proton = Số electron.
Thứ tự các lớp và phân lớp electron: 1s22s22p5.
→ Cấu hình electron của nguyên tử F là 1s22s22p5 hoặc [He]2s22p5 hoặc (2, 7).
Câu 13. Nguyên tử potassium (Z = 19) là
A. nguyên tố s.
B. nguyên tố p.
C. nguyên tố d.
D. nguyên tố f.
Đáp án: A
Giải thích:
Nguyên tử K có số hiệu nguyên tử Z = 19 = Số proton = Số electron.
Thứ tự các lớp và phân lớp electron: 1s22s22p63s23p64s1.
Có thể thay 1s22s22p63s23p6 bằng kí hiệu [Ar]. Cấu hình electron của nguyên tử K là 1s22s22p63s23p64s1 hoặc [Ar]4s1 hoặc (2, 8, 8, 1).
Electron cuối cùng điền vào phân lớp s nên potassium là nguyên tố s.
Câu 14. Nguyên tố mà nguyên tử có 1, 2, 3 electron lớp ngoài cùng thường là
A. nguyên tố khí hiếm.
B. nguyên tố phi kim.
C. nguyên tố kim loại.
D. nguyên tố phóng xạ.
Đáp án: C
Giải thích:
Dựa vào đặc điểm về cấu hình electron lớp ngoài cùng để dự đoán tính chất hóa học cơ bản của nguyên tố:
- Nguyên tố mà nguyên tử đủ 8 electron lớp ngoài cùng là khí hiếm (trừ He).
- Nguyên tố mà nguyên tử có 1, 2, 3 electron lớp ngoài cùng thường là nguyên tố kim loại.
- Các nguyên tố mà nguyên tử có 4 electron lớp ngoài cùng có thể là kim loại hoặc phi kim.
- Nguyên tố mà nguyên tử có 5, 6, 7 electron lớp ngoài cùng thường là nguyên tố phi kim.
Câu 15. Nguyên tử nguyên tố X có Z = 16. Nguyên tố X là
A. nguyên tố kim loại.
B. nguyên tố phi kim.
C. nguyên tố khí hiếm.
D. nguyên tố phóng xạ.
Đáp án: B
Giải thích:
Cấu hình electron của nguyên tử X là: 1s22s22p63s23p4 hoặc [Ne]3s23p4.
Nguyên tử nguyên tố X có 6 electron lớp ngoài cùng→ X là nguyên tố phi kim.
Các câu hỏi trắc nghiệm Hóa học lớp 10 sách Kết nối tri thức có đáp án, chọn lọc khác:
Trắc nghiệm Bài 4: Ôn tập chương 1
Trắc nghiệm Bài 5: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Trắc nghiệm Bài 7: Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì
Trắc nghiệm Bài 8: Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Xem thêm các chương trình khác:
- Trắc nghiệm Toán lớp 10 có đáp án – Chân trời sáng tạo
- Trắc nghiệm Địa Lí lớp 10 có đáp án – Chân trời sáng tạo
- Trắc nghiệm GDTC lớp 10 có đáp án – Chân trời sáng tạo
- Trắc nghiệm Lịch sử lớp 10 có đáp án – Chân trời sáng tạo
- Trắc nghiệm Sinh học lớp 10 có đáp án – Chân trời sáng tạo
- Trắc nghiệm Kinh tế pháp luật lớp 10 có đáp án - Chân trời sáng tạo
- Trắc nghiệm Vật lí lớp 10 có đáp án - Chân trời sáng tạo
- Trắc nghiệm Hóa học lớp 10 có đáp án - Chân trời sáng tạo
- Trắc nghiệm Hóa học lớp 10 có đáp án – Cánh Diều
- Trắc nghiệm Vật Lí lớp 10 có đáp án – Cánh Diều
- Trắc nghiệm Địa Lí lớp 10 có đáp án – Cánh Diều
- Trắc nghiệm Công nghệ lớp 10 có đáp án – Cánh Diều
- Trắc nghiệm Giáo Dục Quốc Phòng lớp 10 có đáp án – Cánh Diều
- Trắc nghiệm GDTC lớp 10 có đáp án – Cánh Diều
