TOP 15 câu Trắc nghiệm Hydrogen halide. Muối halide (Kết nối tri thức 2024) có đáp án - Hóa học 10
Bộ 15 bài tập trắc nghiệm Hóa học lớp 10 Bài 22: Hydrogen halide. Muối halide có đáp án đầy đủ các mức độ sách Kết nối tri thức giúp học sinh ôn luyện trắc nghiệm Hóa học 10 Bài 22.
Chỉ 150k mua trọn bộ Trắc nghiệm Hóa lớp 10 Kết nối tri thức bản word (cả năm) có đáp án chi tiết:
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận tài liệu.
Xem thử tài liệu tại đây: Link tài liệu
Trắc nghiệm Hóa học 10 Bài 22: Hydrogen halide. Muối halide - Kết nối tri thức
Câu 1. Phân tử hydrogen halide (HX) gồm
A. một liên kết ion.
B. một liên kết cộng hóa trị.
C. một liên kết cho nhận.
D. một liên kết hydrogen.
Đáp án: B
Giải thích:
Phân tử hydrogen halide (HX) gồm một liên kết cộng hóa trị. Các phân tử HX là phân tử phân cực.
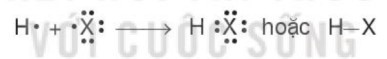
Câu 2. Ở điều kiện thường, hydrogen halide
A. tồn tại ở thể khí, tan ít trong nước.
B. tồn tại ở thể lỏng, tan ít trong nước.
C. tồn tại ở thể khí, tan tốt trong nước.
D. tồn tại ở thể lỏng, tan tốt trong nước.
Đáp án: C
Giải thích:
Ở điều kiện thường, hydrogen halide tồn tại ở thể khí, tan tốt trong nước, tạo thành dung dịch hydrohalic aicd tương ứng.
Câu 3. Từ HCl đến HI, nhiệt độ sôi
A. tăng dần.
B. giảm dần.
C. tăng sau đó giảm.
D. giảm sau đó tăng.
Đáp án: A
Giải thích:
Từ HCl đến HI, nhiệt độ sôi tăng do:
- Lực tương tác van der Waals giữa các phân tử tăng.
- Khối lượng phân tử tăng.
Câu 4. Cho phương trình hóa học của phản ứng:
![]()
Trong phản ứng trên, HCl đóng vai trò là
A. chất oxi hóa.
B. chất khử.
C. vừa là chất oxi hóa, vừa là chất khử.
D. không là chất oxi hóa, không là chất khử.
Đáp án: B
Giải thích:
Phương trình hóa học: ![]() .
.
→HCl là chất khử; KMnO4 là chất oxi hóa.
Chú ý: Ngoài tính acid, hydrohalic acid còn có tính khử.
Câu 5. Chất nào sau đây không tác dụng với dung dịch hydrochloric acid?
A. Cu.
B. MgO.
C. Cu(OH)2.
D. AgNO3.
Đáp án: A
Giải thích:
Kim loại Cu không tác dụng với dung dịch hydrochloric acid.
MgO, Cu(OH)2, AgNO3 tác dụng với dung dịch hydrochloric acid.
Phương trình hóa học:
MgO + 2HCl → MgCl2 + H2O
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
AgNO3 + HCl → AgCl↓ + HNO3
Câu 6. Acid nào sau đây có khả năng ăn mòn thủy tinh vô cơ (có thành phần gần đúng là Na2O.CaO.6SiO2)?
A. HI.
B. HBr.
C. HCl.
D. HF.
Đáp án: D
Giải thích:
Hydrofluoric acid còn có khả năng đặc biệt là ăn mòn thủy tinh vô cơ (có thành phần gần đúng là Na2O.CaO.6SiO2) do xảy ra phản ứng:
SiO2 + 4HF → SiF4 + 2H2O
Câu 7. Nhận xét nào sau đây là đúng?
A. Hầu hết các muối halide đều không trong nước.
B. Hầu hết các muối halide đều dễ tan trong nước.
C. Tất cả các muối halide đều không trong nước.
D. Tất cả các muối halide đều dễ tan trong nước.
Đáp án: B
Giải thích:
Hầu hết các muối halide đều dễ tan trong nước, trừ một số muối không tan silver chloride, silver bromide, silver iodide và một số muối ít tan như lead chloride, lead bromide.
Câu 8. Nhỏ từ từ dung dịch NaCl vào dung dịch AgNO3. Nêu hiện tượng quan sát được.
A. Thấy có khí thoát ra.
B. Thấy xuất hiện kết tủa trắng.
C. Thấy xuất hiện kết tủa vàng.
D. Không có hiện tượng gì.
Đáp án: B
Giải thích:
Nhỏ từ từ dung dịch NaCl vào dung dịch AgNO3.
Hiện tượng: Thấy xuất hiện kết tủa trắng.
Phương trình hóa học: NaCl + AgNO3 → NaNO3 + AgCl¯.
Câu 9. Có thể dùng dung dịch nào sau đây để phân biệt các ion halide?
A. NaOH.
B. H2SO4.
C. AgNO3.
D. Ba(OH)2.
Đáp án: C
Giải thích:
Có thể dùng dung dịch silver nitrate (AgNO3) để phân biệt các ion halide.
Ví dụ:
NaF + AgNO3 → Không xảy ra
NaCl + AgNO3 → NaNO3 + AgCl¯ (kết tủa trắng)
NaBr + AgNO3→ NaNO3 + AgBr¯ (kết tủa vàng nhạt)
NaI + AgNO3→NaNO3 + AgI¯ (kết tủa màu vàng)
Câu 10. Sodium bromide khử được sulfuric acid đặc thành
A. hydrogen sulfide.
B. sulfur.
C. hydrogen.
D. sulfur dioxide.
Đáp án: D
Giải thích:
Sodium bromide khử được sulfuric acid đặc thành sulfur dioxide:
2NaBr + 2H2SO4→ Na2SO4 + Br2 + SO2 + 2H2O
Câu 11. Tính khử của các ion halide tăng dần theo thứ tự
A. Cl- < Br- < I-.
B. Br- < I- < Cl-.
C. I- < Cl- < Br-.
D. Cl- < I- < Br-.
Đáp án: A
Giải thích:
Tính khử của các ion halide tăng dần theo thứ tự Cl- < Br- < I-.
Câu 12. Muối ăn thường được sản xuất từ
A. nước vôi trong.
B. nước biển.
C. nước giếng.
D. nước sông suối.
Đáp án: B
Giải thích:
Muối ăn thường được sản xuất từ nước biển bằng phương pháp kết tinh nhờ quá trình làm bay hơi nước biển dưới sức nóng của Mặt Trời.
Câu 13. Phát biểu nào sau đây không đúng?
A. Trong công nghiệp, hỗn hợp có thành phần KF.3HF được dùng để điện phân nóng chảy sản xuất fluorine.
B. Sodium iodide có thể khử được sulfuric acid đặc thành hydrogen.
C. Trong đời sống, muối ăn được dùng sản xuất nước muối sinh lí, nước nhỏ mắt, dịch tiêm truyền tĩnh mạch, …
D. Các phân tử hydrogen halide (HX) là phân tử phân cực.
Đáp án: B
Giải thích:
Sodium iodide có thể khử được sulfuric acid đặc thành hydrogen sulfide:
8NaI + 5H2SO4 ® 4Na2SO4 + 4I2 + H2S + 4H2O
Câu 14. Để pha 500g nước muối sinh lí NaCl 0,9% dùng làm nước xúc miệng thì cần bao nhiêu gam muối ăn?
A. 4,5 gam.
B. 5,5 gam.
C. 7,5 gam.
D. 9,0 gam.
Đáp án: A
Giải thích:
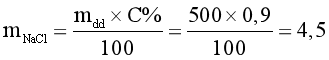 (gam).
(gam).
Câu 15. Cho X, Y là hai nguyên tố halogen có trong tự nhiên, ở hai chu kì liên tiếp (ZX < ZY). Hòa tan hoàn toàn 11 gam hỗn hợp NaX và NaY vào nước thu được dung dịch A. Cho từ từ A vào cốc đựng dung dịch AgNO3 dư, thu được 23,75 gam kết tủa. Biết cả NaX và NaY đều tạo kết tủa với AgNO3. Kí hiệu của hai nguyên tố X và Y lần lượt là
A. F và Cl.
B. Cl và Br.
C. Br và I.
D. Cl và I.
Đáp án: B
Giải thích:
Gọi công thức chung của hai muối NaX và NaY là ![]() .
.
Phương trình hóa học: ![]() + AgNO3 ®
+ AgNO3 ® ![]() + NaNO3.
+ NaNO3.
→ 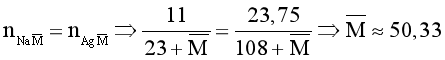 .
.
→ Nguyên tố X là Cl (M = 35,5) và nguyên tố Y là Br (M = 80).
Các câu hỏi trắc nghiệm Hóa học lớp 10 sách Kết nối tri thức có đáp án, chọn lọc khác:
Trắc nghiệm Bài 18: Ôn tập chương 5
Trắc nghiệm Bài 19: Tốc độ phản ứng
Xem thêm các chương trình khác:
- Trắc nghiệm Toán lớp 10 có đáp án – Chân trời sáng tạo
- Trắc nghiệm Địa Lí lớp 10 có đáp án – Chân trời sáng tạo
- Trắc nghiệm GDTC lớp 10 có đáp án – Chân trời sáng tạo
- Trắc nghiệm Lịch sử lớp 10 có đáp án – Chân trời sáng tạo
- Trắc nghiệm Sinh học lớp 10 có đáp án – Chân trời sáng tạo
- Trắc nghiệm Kinh tế pháp luật lớp 10 có đáp án - Chân trời sáng tạo
- Trắc nghiệm Vật lí lớp 10 có đáp án - Chân trời sáng tạo
- Trắc nghiệm Hóa học lớp 10 có đáp án - Chân trời sáng tạo
- Trắc nghiệm Hóa học lớp 10 có đáp án – Cánh Diều
- Trắc nghiệm Vật Lí lớp 10 có đáp án – Cánh Diều
- Trắc nghiệm Địa Lí lớp 10 có đáp án – Cánh Diều
- Trắc nghiệm Công nghệ lớp 10 có đáp án – Cánh Diều
- Trắc nghiệm Giáo Dục Quốc Phòng lớp 10 có đáp án – Cánh Diều
- Trắc nghiệm GDTC lớp 10 có đáp án – Cánh Diều
