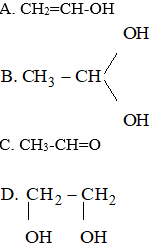Giải SBT Hóa 11 Bài 33: Luyện tập ankin
Lời giải sách bài tập Hóa học lớp 11 Bài 33: Luyện tập ankin chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong sách bài tập Hóa 11 Bài 33. Mời các bạn đón xem:
Mục lục Giải SBT Hóa 11 Bài 33: Luyện tập ankin
1. Công thức phân tử nào cho dưới đây phù hợp với penten?
A. C5H8
B. C5H10
C. C5H12
D. C3H6
Lời giải:
Đáp án B
Penten là anken, có công thức chung CnH2n, vậy đáp án B thỏa mãn.
2. Hợp chất nào dưới đây là ankin?
A. C2H2
B. C8H8
C. C4H4
D. C6H6
Lời giải:
Đáp án A
Công thức chung của ankin là CnH2n-2, vậy đáp án A thỏa mãn.
A. -C3H5
B. -C6H5
C. -C2H3
D. -C2H5
Lời giải:
Đáp án D
Ankan mất đi 1 H được gốc ankyl
C2H5 - : gốc etyl
1. Trong 4 chất sau, chất nào có nhiệt độ sôi cao nhất là?
A. eten.
B. propen.
C. but-1-en.
D. pent-1-en.
Lời giải:
Đáp án D
Pent – 1 – en có phân tử khối lớn nhất nên có nhiệt độ sôi cao nhất.
2. Chất nào dưới đây không tác đụng với dung dịch AgNO3 trong amoniac?
A. but-1-in
B. but-2-in
C. propin
D. etin
Lời giải:
Đáp án B
But – 2 – in không có liên kết ba đầu mạch nên không tác dụng với AgNO3/ NH3.
3. Chất nào sau đây không tác dụng với Br2 (tan trong CCl4) là?
A. but-1-in.
B. but-1-en.
C. xiclobutan.
D. xiclopropan.
Lời giải:
Đáp án C
Xiclobutan có vòng 4 cạnh, nên không có phản ứng cộng mở vòng với brom.
Bài 33.3 trang 51 sbt Hóa 11: Cho propin tác dụng với HCl theo hai gian đoạn liên tiếp thì sản phẩm chính thu được là:
Lời giải:
Đáp án D
CH≡C – CH3 CH2 = CCl – CH3 CH3-CCl2-CH3.
Bài 33.4 trang 51 sbt Hóa 11: Cho axetilen phản ứng cộng với nước, xúc tác là HgSO4 và H2SO4 thì sản phẩm cuối cùng thu được là
Lời giải:
Đáp án C
CH ≡ CH + H2O CH3CHO
Bài 33.5 trang 51 sbt Hóa 11: Viết phương trình hoá học của các phản ứng xảy ra trong quá trình điều chế PVC xuất phát từ các chất vô cơ: CaO, HCl, H2O, C.
Lời giải:
Phương trình hóa học:
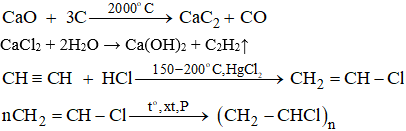
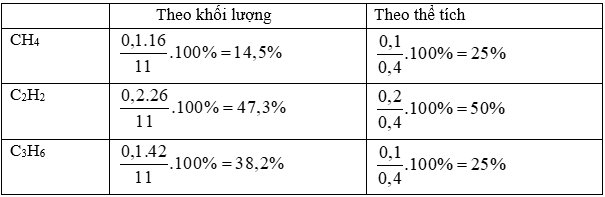
Bài 33.6 trang 52 sbt Hóa 11: Hỗn hợp khí A chứa metan, axetilen và propen. Đốt cháy hoàn toàn 11 g hỗn hợp A, thu được 12,6 g H2O. Mặt khác, nếu dẫn 11,2 lít A (đktc) qua nước brom (lấy dư) thì khối lượng brom nguyên chất phản ứng tối đa là 100 g.
Hãy xác định thành phần phần trăm theo khối lượng và theo thể tích của từng chất trong hỗn hợp A.
Lời giải:
Giả sử trong 11 gam hỗn hợp A có x mol CH4, y mol C2H2 và z mol C3H6:
16x + 26y + 42z = 11 (1)
Khi đốt cháy 11 g A:
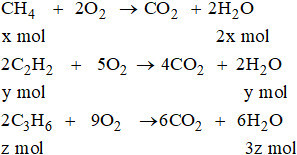
Số mol H2O:
2x + y + 3z = 0,7 (mol) (2)
Số mol A được dẫn qua nước brom là: mol
Số mol Br2 đã dự phản ứng: mol
Nếu dẫn 11 g A đi qua nước brom:
CH4 không phản ứng
x mol
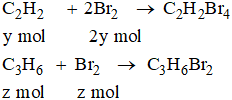
Như vậy: (x + y + z) mol A tác dụng với (2y + z) mol Br2, 0,500 mol A tác dụng với 0,625 mol Br2
suy ra 5x + z = 3y
Giải hệ phương trình, tìm được x = 0,1; y = 0,2; z = 0,1
Thành phần phần trăm các chất trong hỗn hợp A:
Bài 33.7 trang 52 sbt Hóa 11: Một bình kín dung tích 8,4 lít có chứa 4,96 g 02 và 1,3 gam hỗn hợp khí A gồm 2 hiđrocacbon. Nhiệt độ trong bình t1 = 0oC và áp suất trong bình p1 = 0,5 atm.
1. Tính p2, biết rằng thể tích bình không đổi.
Lời giải:
H2SO4 + nH2O → H2SO4.nH2O
2NaOH + CO2 → Na2CO3 + H2O
Số mol CO2 là: mol
Khối lượng C trong hỗn hợp A là: 0,095.12 = 1,14 (g).
Khối lượng H trong hỗn hợp A là: 1,3 - 1,14 = 0,16 (g).
Số mol H2O sau phản ứng là: mol
Để tạo ra 0,095 mol CO2 cần 0,095 mol O2;
Để tạo ra 0,08 mol H2O cần 0,04 (mol) O2.
Số mol O2 đã tham gia phản ứng là: 0,095 + 0,04 = 0,135 (mol).
Số mol O2 ban đầu là: mol
Số mol O2 còn dư là: 0,155 - 0,135 = 0,02 (mol).
Số mol 3 chất trong bình sau phản ứng:
0,095 + 0,08 + 0,02 = 0,195 (mol).
Nếu ở đktc thì Vo = 0,195.22,4 = 4,37 (lít).
Thực tế V2 = 8,4 lít
Suy ra
= 0,78 atm
2. Đổi thể tích hỗn hợp khí trước phản ứng về đktc:
Số mol khí trước phản ứng: mol
Số mol 2 hiđrocacbon: 0,1875 - 0,155 = 0,0325 (mol).
Đặt lượng CnH2n là a mol, lượng CmH2m-2 là b mol,
ta có a + b = 0,0325.
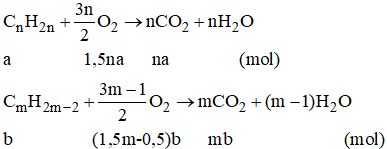
Số mol O2: l,5na + (l,5m - 0,5)b = 0,135 (2)
Số mol CO2: na + mb = 0,095 (3)
Từ (2) và (3), tìm được b = 0,015 ⇒ a = 0,0175
Thay các giá trị của a và b vào (3), ta có:
1,75.10−2n + 1,5.10−2m = 9,5.10−2
7n + 6m = 38
Nếu n = 2 thì
Nếu n = 3 thì (loại)
Nếu n > 3 thì m < 2 (loại).
% về thể tích của C2H4:
% về thể tích của C4H6 là 46,2%
Bài 33.8 trang 52 sbt Hóa 11: Trình bày phương pháp hoá học để phân biệt các hiđrocacbon sau:
Lời giải:
1. Dùng phản ứng với nước brom, axetilen làm mất màu dung dịch brom còn metan thì không.
CH≡CH + 2Br2 → CHBr2 – CHBr2
2. Dùng phản ứng với dung dịch AgNO3 trong amoniac, axetilen tạo kết tủa vàng còn etilen thì không.
CH≡CH + 2AgNO3 + 2NH3 → CAg≡CAg (↓ vàng) + 2NH4NO3
3. Dùng phản ứng với dung dịch AgNO3 trong amoniac sau đó dùng phản ứng với nước brom. Cách tiến hành:
+ Dẫn lần lượt từng khí qua dung dịch AgNO3/NH3, nếu có kết tủa vàng xuất hiện chứng tỏ khí là axetilen.
CH≡CH + 2AgNO3 + 2NH3 → CAg≡CAg (↓ vàng) + 2NH4NO3
+ Hai khí còn lại là etilen và metan, dẫn qua dung dịch brom. Nếu dung dịch brom nhạt dần đến mất màu thì khí là etilen, không hiện tượng là metan,
CH2 = CH2 + Br2 → CH2Br – CH2Br
4. Dùng phản ứng với dung dịch AgNO3 trong amoniac, but – 1 – in tạo kết tủa vàng, còn but – 2 – in thì không.
CH≡C – CH2 – CH3 + AgNO3 + NH3 → CAg≡C – CH2 – CH3 + NH4NO3
Bài 33.9 trang 52 sbt Hóa 11: Cho biết phương pháp làm sạch chất khí:
1. metan lẫn tạp chất là axetilen và etilen;
2. etilen lẫn tạp chất là axetilen.
Lời giải:
Đáp án
1. Dẫn hỗn hợp khí đi qua nước brom (lấy dư), chỉ có metan lẫn hơi nước thoát ra. Sau đó dẫn metan đi qua H2SO4 đặc để làm khô.
CH2 = CH2 + Br2 → CH2Br – CH2Br
CH≡CH + 2Br2 → CHBr2 – CHBr2
2. Dẫn hỗn hợp khí đi qua lượng dư dung dịch AgNO3 trong amoniac, khí thoát ra khỏi dung dịch là etilen có lẫn hơi nước. Sau đó dẫn etilen đi qua H2SO4 đặc để làm khô.
CH≡CH + 2AgNO3 + 2NH3 → CAg≡CAg (↓ vàng) + 2NH4NO3
Xem thêm lời giải sách bài tập Hóa học lớp 11 hay, chi tiết khác:
Bài 35: Benzen và đồng đẳng. Một số hidrocacbon thơm khác
Bài 36: Luyện tập hidrocacbon thơm
Bài 37: Nguồn hidrocacbon thiên nhiên
Bài 38: Hệ thống hóa về hidrocacbon
Bài 39: Dẫn xuất halogen của hidrocacbon
Xem thêm tài liệu Hóa học lớp 11 hay, chi tiết khác:
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 11 (hay nhất) | Để học tốt Ngữ Văn 11 (sách mới)
- Soạn văn 11 (ngắn nhất) | Để học tốt Ngữ văn 11 (sách mới)
- Tác giả tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Văn mẫu 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Toán 11 | Giải bài tập Toán 11 Học kì 1, Học kì 2 (sách mới)
- Các dạng bài tập Toán lớp 11
- Lý thuyết Toán lớp 11 (sách mới) | Kiến thức trọng tâm Toán 11
- Giáo án Toán lớp 11 mới nhất
- Bài tập Toán lớp 11 mới nhất
- Chuyên đề Toán lớp 11 mới nhất
- Giải sgk Tiếng Anh 11 (thí điểm)
- Giải sgk Tiếng Anh 11 | Giải bài tập Tiếng anh 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Tiếng Anh 11 (sách mới) | Sách bài tập Tiếng Anh 11
- Giải sbt Tiếng Anh 11 (thí điểm)
- Giải sgk Lịch sử 11 | Giải bài tập Lịch sử 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Lịch Sử 11(sách mới) | Kiến thức trọng tâm Lịch Sử 11
- Giải Tập bản đồ Lịch sử 11
- Giải sgk Vật Lí 11 | Giải bài tập Vật lí 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 11 (sách mới) | Sách bài tập Vật Lí 11
- Lý thuyết Vật Lí 11 (sách mới) | Kiến thức trọng tâm Vật Lí 11
- Các dạng bài tập Vật Lí lớp 11
- Giáo án Vật lí lớp 11 mới nhất
- Giải sgk Sinh học 11 | Giải bài tập Sinh học 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Sinh học 11 (sách mới) | Kiến thức trọng tâm Sinh 11
- Giải sgk Giáo dục công dân 11
- Lý thuyết Giáo dục công dân 11
- Lý thuyết Địa Lí 11 (sách mới) | Kiến thức trọng tâm Địa lí 11
- Giải Tập bản đồ Địa Lí 11
- Giải sgk Giáo dục quốc phòng - an ninh 11