Giải SBT Hóa 11 Bài 5: Luyện tập axit, bazơ và muối. Phản ứng trao đổi ion trong dung dịch các chất điện li
Lời giải vở bài tập Hóa học lớp 11 Bài 5: Luyện tập axit, bazơ và muối. Phản ứng trao đổi ion trong dung dịch các chất điện li chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong Vở bài tập Hóa 11 Bài 5. Mời các bạn đón xem:
Mục lục Giải SBT Hóa 11 Bài 5: Luyện tập axit, bazơ và muối. Phản ứng trao đổi ion trong dung dịch các chất điện li
Bài 5.1 trang 8 sbt Hóa 11: Một mẫu nước mưa có pH = 4,82. Vậy nồng độ H+ trong đó là:
Lời giải:
Đáp án C
pH = 4,82 suy ra [H+] = 10-4,82M > 10-5M
Bài 5.2 trang 8 sbt Hóa 11: Dung dịch axit mạnh một nấc X nồng độ 0,010 mol/l có pH = 2 và dung dịch bazơ mạnh một nấc Y nồng độ 0,010 mol/l có pH = 12. Vậy:
A. X và Y là các chất điện li mạnh.
B. X và Y là các chất điện li yếu.
C. X là chất điện li mạnh, Y là chất điện li yếu.
D. X là chất điện li yếu, Y là chất điện li mạnh.
Lời giải:
Đáp án A
pH = 2 suy ra [H+] = 10-2 = 0,01 =
Do đó, X điện li hoàn toàn nên X là chất điện li mạnh.
pH = 12 suy ra [H+] = 10-12 suy ra [OH-] = = 10-2 =
Do đó, Y điện li hoàn toàn nên Y là chất điện li mạnh.
Bài 5.3 trang 8 sbt Hóa 11: Dung dịch axit mạnh H2SO4 0,10M có:
Lời giải:
Đáp án B
Phương trình điện li:
Suy ra [H+] = 0,2M
Vậy pH gần bằng 0,7
Bài 5.4 trang 8 sbt Hóa 11: Dung dịch chất A có pH = 3. Cần thêm V2 ml nước vào V1 ml dung dịch chất A để pha loãng thành dung dịch có pH = 4. Biểu thức liên hệ giữa V1 và V2 là
Lời giải:
Đáp án A
Lúc đầu: [H+] = 10-3 suy ra = 10-6V1
Lúc sau: [H+] = 10-4 suy ra = 10-7 (V1 + V2)
Khi pha loãng số mol H+ không đổi nên:
10-6V1 = 10-7 (V1 + V2) suy ra V2 = 9V1
Bài 5.5 trang 8 sbt Hóa 11: Nồng độ H+ trong rượu vang là 3,2.10-4M. Sau khi mở nút chai để hở trong không khí một tháng, nồng độ H+ là 1.10-3M. Hỏi pH của rượu vang tăng lên hay giảm xuống sau khi để trong không khí?
Lời giải:
pH của rượu vang giảm xuống sau khi để trong không khí.
Lúc đầu pH = -log(3,2.10-4) = 3,495
Lúc sau pH = -log(10-3) = 3
Bài 5.6 trang 8 sbt Hóa 11: Viết phương trình dạng phân tử ứng với phương trình ion rút gọn sau:
Lời giải:
1. BaCl2 + Na2CO3 → BaCO3↓ + 2NaCl
2. 2FeCl3 + 3Ba(OH)2 → 2Fe(OH)3↓ + 3BaCl2
3. (NH4)2SO4 + 2KOH → 2NH3↑ + 2H2O + K2SO4
4. Na2S + 2HCl → H2S ↑ + 2NaCl
5. NaOH + HClO → NaClO + H2O
6. CO2 + 2NaOH → Na2CO3 + H2O
Bài 5.7 trang 8 sbt Hóa 11: Viết phương trình dạng phân tử và ion rút gọn của các phản ứng trong dung dịch theo sơ đồ sau:
Lời giải:
1. Phương trình phân tử:
Pb(NO3)2 + 2KCl → PbCl2 + 2KNO3
Phương trình ion thu gọn:
Pb2+ + 2Cl - → PbCl2↓
2. Phương trình phân tử:
Sn(OH)2 + 2NaOH → Na2SnO2 + 2H2O
Phương trình ion thu gọn:
Sn(OH)2 + 2OH- → SnO22- + 2H2O
3. Phương trình phân tử:
MgCO3 + 2HCl → MgCl2 + CO2 + H2O
Phương trình ion thu gọn:
MgCO3 + 2H+ → Mg2+ + CO2 + H2O
4. Phương trình phân tử:
CaHPO4 + 2HNO3 → H3PO4 + Ca(NO3)2
Phương trình ion thu gọn:
CaHPO4 + 2H+ → H3PO4 + Ca2+
5. Phương trình phân tử:
FeS + 2HCl → FeCl2 + H2S
Phương trình ion thu gọn:
FeS + 2H+ → Fe2+ + H2S
6. Phương trình phân tử:
Fe2(SO4)3 + 6KOH → 3K2SO4 + 2Fe(OH)3↓
Phương trình ion thu gọn:
Fe3+ + 3OH- → Fe(OH)3↓
Bài 5.8 trang 9 sbt Hóa 11: Hoà tan hoàn toàn 0,12 g Mg trong 100,0 ml dung dịch HCl 0,20 M. Tính pH của dung dịch sau khi phản ứng kết thúc (thể tích dung dịch biến đổi không đáng kể).
Lời giải:
(mol)
(mol)
Số mol HCl còn lại sau phản ứng: 0,02 - 0,01 = 0,01 (mol).
Từ đó, số mol HCl trong 1000 ml là 0,1 mol, nghĩa là sau phản ứng
[HCl] = 0,1M = 10−1M.
Vậy pH = 1.
Bài 5.9 trang 9 sbt Hóa 11: Trong nước biển, magie là kim loại có hàm lượng lớn thứ hai sau natri. Mỗi kilogam nước biển chứa khoảng 1,3 g magie dưới dạng các ion Mg2+. Ở nhiều quốc gia, magie được khai thác từ nước biển. Quá trình sản xuất magie từ nước biển gồm các giai đoạn sau:
1. Nung đá vôi thành vôi sống.
2. Hoà tan vôi sống trong nước biển tạo ra kết tủa Mg(OH)2.
3. Hoà tan kết tủa Mg(OH)2 trong dung dịch HCl.
Viết các phương trình hoá học dưới dạng phân tử và ion rút gọn (nếu có) của quá trình sản xuất trên.
Lời giải:
1. Nung đá vôi thành vôi sống:
CaCO3 CaO + CO2↑
2. Hòa tan vôi sống trong nước biển:
CaO + H2O → Ca(OH)2
Mg2+ + 2OH− → Mg(OH)2
3. Hòa tan kết tủa Mg(OH)2 trong HCl:
Phương trình phân tử:
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
Phương trình ion rút gọn:
Mg(OH)2 + 2H+ → Mg2+ + 2H2O
4. Điện phân MgCl2 nóng chảy:
Bài 5.10 trang 9 sbt Hóa 11: Nước chứa nhiểu ion Ca2+ và Mg2+ là nước cứng. Nước chứa ít hoặc không chứa các ion Ca2+ và Mg2+ là nước mềm. Nước cứng không phù hợp cho việc sử dụng trong công nghiệp và sinh hoạt. Trong nước thường chứa các hợp chất Ca(HCO3)2, Mg(HCO3)2, CaCl2 và MgCl2 hoà tan.
Để loại Ca2+ dưới dạng CaCl2 người ta hoà tan Na2CO3 vào nước sẽ tạo kết tủa CaCO3.
Hãy viết các phương trình hoá học dưới dạng phân tử và ion rút gọn của các phản ứng trên.
Lời giải:
Các phương trình hóa học dưới dạng phân tử và ion rút gọn của các phản ứng trên:
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O
Ca2+ + HCO3− + OH− → CaCO3↓ + H2O
Mg(HCO3)2 + 2Ca(OH)2 → Mg(OH)2↓ + 2CaCO3↓ + 2H2O
Mg2+ + 2HCO3− + 2Ca2+ + 4OH− → Mg(OH)2↓ + 2CaCO3↓ + 2H2O
MgCl2 + Ca(OH)2 → Mg(OH)2↓ + CaCl2
Mg2+ + 2OH− → Mg(OH)2↓
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
Ca2+ + CO32− → CaCO3↓
Bài 5.11 trang 9 sbt Hóa 11: Có 6 dung dịch đựng trong 6 lọ mất nhãn: Mg(NO3)2, Zn(NO3)2, Pb(NO3)2, AlCl3, KOH và NaCl. Chỉ dùng thêm dung dịch AgNO3 và một thuốc thử nữa, hãy trình bày cách nhận biết từng dung dịch. Viết các phương trình hoá học dưới dạng phân tử và ion rút gọn của các phản ứng nhận biết đó.
Lời giải:
Dùng dung dịch phenolphtalein nhận ra dung dịch KOH.
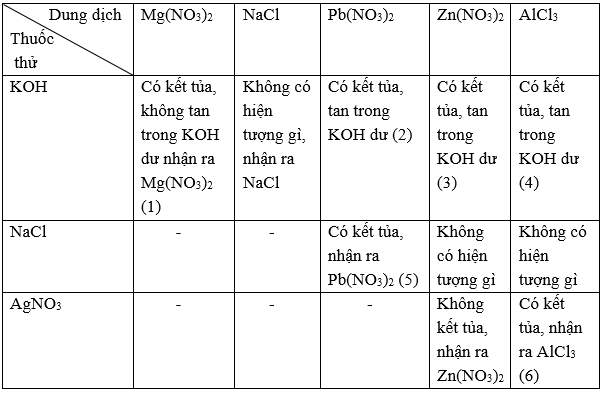
Các phương trình hoá học:
(1) Mg(NO3)2 + 2KOH → Mg(OH)2↓ + 2KNO3
Mg2+ + 2OH− → Mg(OH)2↓
(2) Pb(NO3)2 + 2KOH → Pb(OH)2↓ + 2KNO3
Pb2+ + 2OH− → Pb(OH)2↓
Pb(OH)2 + 2KOH → K2PbO2 + 2H2O
Pb(OH)2 + 2OH− → PbO22− + 2H2O
(3) Zn(NO3)2 + 2KOH → Zn(OH)2↓ + 2KNO3
Zn2+ + 2OH− → Zn(OH)2↓
Zn(OH)2 + 2KOH → K2ZnO2 + 2H2O
Zn(OH)2 + 2OH− → ZnO22− + 2H2O
(4) AlCl3 + 3KOH → Al(OH)3↓ + 3KCl
Al3+ + 3OH− → Al(OH)3↓
Al(OH)3 + KOH → KAlO2 + 2H2O
Al(OH)3 + OH− → AlO2− + 2H2O
(5) 2NaCl + Pb(NO3)2 → 2NaNO3 + PbCl2↓
Pb2+ + 2Cl− → PbCl2↓
(6) 3AgNO3 + AlCl3 → Al(NO3)3 + 3AgCl↓
Ag+ + Cl− → AgCl↓
Xem thêm lời giải sách bài tập Hóa học lớp 11 hay, chi tiết khác:
Bài 9: Axit nitric và muối nitrat
Bài 11: Axit photphoric và muối photphat
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 11 (hay nhất) | Để học tốt Ngữ Văn 11 (sách mới)
- Soạn văn 11 (ngắn nhất) | Để học tốt Ngữ văn 11 (sách mới)
- Tác giả tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Văn mẫu 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Toán 11 | Giải bài tập Toán 11 Học kì 1, Học kì 2 (sách mới)
- Các dạng bài tập Toán lớp 11
- Lý thuyết Toán lớp 11 (sách mới) | Kiến thức trọng tâm Toán 11
- Giáo án Toán lớp 11 mới nhất
- Bài tập Toán lớp 11 mới nhất
- Chuyên đề Toán lớp 11 mới nhất
- Giải sgk Tiếng Anh 11 (thí điểm)
- Giải sgk Tiếng Anh 11 | Giải bài tập Tiếng anh 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Tiếng Anh 11 (sách mới) | Sách bài tập Tiếng Anh 11
- Giải sbt Tiếng Anh 11 (thí điểm)
- Giải sgk Lịch sử 11 | Giải bài tập Lịch sử 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Lịch Sử 11(sách mới) | Kiến thức trọng tâm Lịch Sử 11
- Giải Tập bản đồ Lịch sử 11
- Giải sgk Vật Lí 11 | Giải bài tập Vật lí 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 11 (sách mới) | Sách bài tập Vật Lí 11
- Lý thuyết Vật Lí 11 (sách mới) | Kiến thức trọng tâm Vật Lí 11
- Các dạng bài tập Vật Lí lớp 11
- Giáo án Vật lí lớp 11 mới nhất
- Giải sgk Sinh học 11 | Giải bài tập Sinh học 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Sinh học 11 (sách mới) | Kiến thức trọng tâm Sinh 11
- Giải sgk Giáo dục công dân 11
- Lý thuyết Giáo dục công dân 11
- Lý thuyết Địa Lí 11 (sách mới) | Kiến thức trọng tâm Địa lí 11
- Giải Tập bản đồ Địa Lí 11
- Giải sgk Giáo dục quốc phòng - an ninh 11
