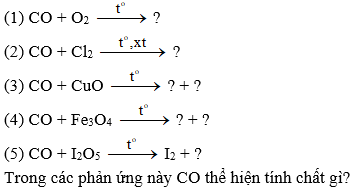Giải SBT Hóa 11 Bài 16: Hợp chất của cacbon
Lời giải sách bài tập Hóa học lớp 11 Bài 16: Hợp chất của cacbon chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong sách bài tập Hóa 11 Bài 16. Mời các bạn đón xem:
Mục lục Giải SBT Hóa 11 Bài 16: Hợp chất của cacbon
Bài 16.1 trang 23 sbt Hóa 11: Nhận xét nào sau đây là đúng?
A. CO và CO2 đều là chất khí không màu, không mùi, không vị và nặng hơn không khí.
C. CO và CO2 đều oxit của phi kim vì vậy chúng đều là oxit axit.
D. Bằng phản ứng hóa học có thể biến đổi CO thành CO2 và cũng có thể biến đổi CO2 thành CO.
Lời giải:
Đáp án D
A. Sai vì CO nhẹ hơn không khí.
B. Sai vì CO khó hóa lỏng.
C. Sai vì CO là oxit trung tính.
Bài 16.2 trang 23 sbt Hóa 11: Cần thêm ít nhất bao nhiêu ml dung dịch Na2CO3 0,15M vào 25 ml dung dịch Al2(SO4)3 0,02M để làm kết tủa hoàn toàn ion nhôm dưới dạng Al(OH)3? Biết rằng phản ứng cho thoát ra khí CO2.
Lời giải:
Đáp án B
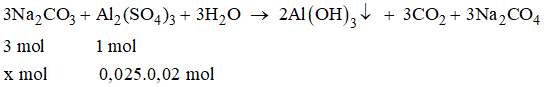
Suy ra x = 0,0015 mol
(lít) = 10 ml
Bài 16.3 trang 24 sbt Hóa 11: Hoàn thành các phương trình hoá học sau đây (ghi rõ số oxi hoá của cacbon):
Lời giải:

Bài 16.4 trang 24 sbt Hóa 11: Hoàn thành các phương trình hoá học sau:
Lời giải:
(1) CO2 + 2Mg 2MgO + C
(2) CO2 + CaO → CaCO3
(3) 2CO2(dư) + Ba(OH)2 → Ba(HCO3)2
(4) CO2 + H2O ⇆ H2CO3
(5) CO2 + CaCO3 + H2O ⇆ Ca(HCO3)2
(6) 6CO2 + 6H2O C6H12O6 + 6O2
Bài 16.5 trang 24 sbt Hóa 11: Hãy điền dấu (+) vào trường hợp nào có và dấu (-) vào trường hợp nào không có phản ứng hoá học xảy ra giữa các chất sau đây:
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Lời giải:
|
|
CO2 (k) |
(NH4)2CO3 (dd) |
NaHCO3 (dd) |
Ba(HCO3)2 (dd) |
|
Na2SO4 (dd) |
- |
- |
- |
+ |
|
NaOH (dd) |
+ |
+ |
+ |
+ |
|
BaCl2 (dd) |
- |
+ |
- |
- |
|
CaO (r) |
+ |
+ |
+ |
+ |
Bài 16.6 trang 24 sbt Hóa 11: Có một hỗn hợp ba muối NH4HCO3, NaHCO3, Ca(HCO3)2. Khi nung 48,8 g hỗn hợp đó đến khối lượng không đổi, thu được 16,2 g bã rắn. Chế hoá bã rắn với dung dịch HCl lấy dư, thu được 2,24 lít khí (đktc).
Xác định thành phần phần trăm của các muối trong hỗn hợp.
Lời giải:
Các phản ứng phân hủy muối khi nung:
NH4HCO3 NH3 + CO2 + H2O (1)
2NaHCO3 Na2CO3 + CO2 + H2O
Ca(HCO3)2 CaO + 2CO2 + H2O (3)
Bã rắn thu được sau khi nung gồm Na2CO3 và CaO, chúng tan trong dung dịch HCl dư theo các phương trình hoá học:
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O (4)
CaO + 2HCl → CaCl2 + H2O (5)
Theo (4):
= 0,1 (mol), hay 106.0,1 = 10,6 (g) Na2CO3
Theo (2):
= 2.0,1 = 0,2 (mol), hay 84.0,2 = 16,8 (g) NaHCO3.
Số mol CaO có trong bã rắn: (mol)
Theo (3):
= 0,1 (mol), hay 162.0,1 = 16,2 (g) Ca(HCO3)2.
Khối lượng NH4HCO3 có trong hỗn hợp: 48,8 - (16,8 + 16,2) = 15,8 (g).
Thành phần phần trăm của hỗn hợp muối:
Xem thêm lời giải sách bài tập Hóa học lớp 11 hay, chi tiết khác:
Bài 17: Silic và hợp chất của silic
Bài 19: Luyện tập tính chất chất của cacbon, silic và các hợp chất của chúng
Bài 20: Mở đầu về hóa học hữu cơ
Bài 21: Công thức phân tử hợp chất hữu cơ
Xem thêm tài liệu Hóa học lớp 11 hay, chi tiết khác:
Trắc nghiệm Hợp chất của cacbon có đáp án
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 11 (hay nhất) | Để học tốt Ngữ Văn 11 (sách mới)
- Soạn văn 11 (ngắn nhất) | Để học tốt Ngữ văn 11 (sách mới)
- Tác giả tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Văn mẫu 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Toán 11 | Giải bài tập Toán 11 Học kì 1, Học kì 2 (sách mới)
- Các dạng bài tập Toán lớp 11
- Lý thuyết Toán lớp 11 (sách mới) | Kiến thức trọng tâm Toán 11
- Giáo án Toán lớp 11 mới nhất
- Bài tập Toán lớp 11 mới nhất
- Chuyên đề Toán lớp 11 mới nhất
- Giải sgk Tiếng Anh 11 (thí điểm)
- Giải sgk Tiếng Anh 11 | Giải bài tập Tiếng anh 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Tiếng Anh 11 (sách mới) | Sách bài tập Tiếng Anh 11
- Giải sbt Tiếng Anh 11 (thí điểm)
- Giải sgk Lịch sử 11 | Giải bài tập Lịch sử 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Lịch Sử 11(sách mới) | Kiến thức trọng tâm Lịch Sử 11
- Giải Tập bản đồ Lịch sử 11
- Giải sgk Vật Lí 11 | Giải bài tập Vật lí 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 11 (sách mới) | Sách bài tập Vật Lí 11
- Lý thuyết Vật Lí 11 (sách mới) | Kiến thức trọng tâm Vật Lí 11
- Các dạng bài tập Vật Lí lớp 11
- Giáo án Vật lí lớp 11 mới nhất
- Giải sgk Sinh học 11 | Giải bài tập Sinh học 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Sinh học 11 (sách mới) | Kiến thức trọng tâm Sinh 11
- Giải sgk Giáo dục công dân 11
- Lý thuyết Giáo dục công dân 11
- Lý thuyết Địa Lí 11 (sách mới) | Kiến thức trọng tâm Địa lí 11
- Giải Tập bản đồ Địa Lí 11
- Giải sgk Giáo dục quốc phòng - an ninh 11