Giải SBT Hóa 11 Bài 1: Sự điện li
Lời giải sách bài tập Hóa học lớp 11 Bài 1: Sự điện li chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong sách bài tập Hóa 11 Bài 1. Mời các bạn đón xem:
Mục lục Giải SBT Hóa 11 Bài 1: Sự điện li
Bài 1.1 trang 3 sbt Hóa 11: Các dung dịch sau đây có cùng nồng độ 0,1 mol/l, dung dịch nào dẫn điện kém nhất?
Lời giải:
Đáp án B
- Chất điện li mạnh thì dẫn điện tốt. Chất điện li yếu thì dẫn điện kém.
Bài 1.2 trang 3 sbt Hóa 11: Dung dịch nào dưới đây dẫn điện tốt nhất?
Lời giải:
Đáp án C
Nồng độ ion trong dung dịch càng lớn, dung dịch dẫn điện càng tốt.
Dung dịch dẫn điện tốt nhất là: NaI 1.10−1M
Bài 1.3 trang 3 sbt Hóa 11:Trong bốn chất sau, chất nào là chất điện li yếu?
Lời giải:
Đáp án A
Chất điện ly mạnh bao gồm các axit mạnh (HCl, H2SO4, …), các bazơ mạnh (NaOH, KOH, …) và các muối tan trong nước.
Vậy chất nào là chất điện li yếu là: H2O
Bài 1.4 trang 3 sbt Hóa 11: Giải thích tại sao khả năng dẫn điện của nước vôi trong (dung dịch Ca(OH)2 trong nước) để trong không khí giảm dần theo thời gian.
Lời giải:
Vì Ca(OH)2 hấp thụ CO2 trong không khí tạo thành kết tủa CaCO3 và H2O làm giảm nồng độ các ion trong dung dịch:
Ca2+ + 2OH- + CO2 → CaCO3↓ + H2O (∗)
Bài 1.5 trang 3 sbt Hóa 11: Viết phương trình điện li của các chất sau trong dung dịch:
1. Các chất điện li mạnh: BeF2, HBrO4, K2CrO4.
2. Các chất điện li yếu: HBrO, HCN.
Lời giải:
1. BeF2 → Be2+ +2F−
HBrO4 → H+ + BrO4-
K2CrO4 → 2K+ + CrO42−
2. HBrO H+ + BrO−
HCN H+ + CN−
Bài 1.6 trang 3 Sbt Hóa 11: Viết phương trình điện li của axit yếu CH3COOH trong dung dịch. Nếu hoà tan ít tinh thể chất điện li mạnh CH3COONa vào dung dịch axit trên thì nồng độ H+ tăng hay giảm? Giải thích dựa vào nguyên lí chuyển dịch cân bằng Lơ Satơliê.
Lời giải:
CH3COOH CH3COO− + H+ (1)
CH3COONa phân li trong dung dịch như sau:
CH3COONa → CH3COO− + Na+
Sự phân li của CH3COOH là quá trình thuận nghịch. Đây là cân bằng động. Khi hoà tan CH3COONa vào thì nồng độ CH3COO− tăng lên, làm cho cân bằng (1) chuyển dịch từ phải sang trái, nên nồng độ H+ giảm xuống.
Bài 1.7 trang 4 SBT Hóa 11: Trong dung dịch CH3COOH 4,3.10-2 M, người ta xác định được nồng độ H+ bằng 8,6.10-4 mol/l. Hỏi có bao nhiêu phần trăm phân tử CH3COOH trong dung dịch này điện li ra ion?
Lời giải:
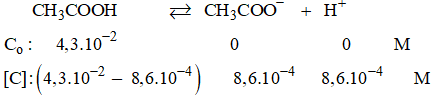
Phần trăm phân tử CH3COOH phân li ra ion là:
Chú ý: Co: Nồng độ ban đầu, [C] nồng độ cân bằng.
Xem thêm lời giải sách bài tập Hóa học lớp 11 hay, chi tiết khác:
Bài 3: Sự điện li của nước. pH. Chất chỉ thị axit – bazơ
Bài 4: Phản ứng trao đổi ion trong dung dịch các chất điện li
Bài 5: Luyện tập axit, bazơ và muối. Phản ứng trao đổi ion trong dung dịch các chất điện li
Xem thêm tài liệu Hóa học lớp 11 hay, chi tiết khác:
Trắc nghiệm Sự điện li có đáp án
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 11 (hay nhất) | Để học tốt Ngữ Văn 11 (sách mới)
- Soạn văn 11 (ngắn nhất) | Để học tốt Ngữ văn 11 (sách mới)
- Tác giả tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Văn mẫu 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Toán 11 | Giải bài tập Toán 11 Học kì 1, Học kì 2 (sách mới)
- Các dạng bài tập Toán lớp 11
- Lý thuyết Toán lớp 11 (sách mới) | Kiến thức trọng tâm Toán 11
- Giáo án Toán lớp 11 mới nhất
- Bài tập Toán lớp 11 mới nhất
- Chuyên đề Toán lớp 11 mới nhất
- Giải sgk Tiếng Anh 11 (thí điểm)
- Giải sgk Tiếng Anh 11 | Giải bài tập Tiếng anh 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Tiếng Anh 11 (sách mới) | Sách bài tập Tiếng Anh 11
- Giải sbt Tiếng Anh 11 (thí điểm)
- Giải sgk Lịch sử 11 | Giải bài tập Lịch sử 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Lịch Sử 11(sách mới) | Kiến thức trọng tâm Lịch Sử 11
- Giải Tập bản đồ Lịch sử 11
- Giải sgk Vật Lí 11 | Giải bài tập Vật lí 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 11 (sách mới) | Sách bài tập Vật Lí 11
- Lý thuyết Vật Lí 11 (sách mới) | Kiến thức trọng tâm Vật Lí 11
- Các dạng bài tập Vật Lí lớp 11
- Giáo án Vật lí lớp 11 mới nhất
- Giải sgk Sinh học 11 | Giải bài tập Sinh học 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Sinh học 11 (sách mới) | Kiến thức trọng tâm Sinh 11
- Giải sgk Giáo dục công dân 11
- Lý thuyết Giáo dục công dân 11
- Lý thuyết Địa Lí 11 (sách mới) | Kiến thức trọng tâm Địa lí 11
- Giải Tập bản đồ Địa Lí 11
- Giải sgk Giáo dục quốc phòng - an ninh 11
