Trong dung dịch CH3COOH 4,3.10-2 M, người ta xác định được nồng độ H+ bằng 8,6.10-4 mol/l
Với giải bài 1.7 trang 3 sbt Hóa học lớp 11 được biên soạn lời giải chi tiết sẽ giúp học sinh biết cách làm bài tập môn Hóa 11. Mời các bạn đón xem:
Giải Sách bài tập Hoá học lớp 11 Bài 1: Sự điện li
Bài 1.7 trang 4 Sách bài tập Hóa học lớp 11: Trong dung dịch CH3COOH 4,3.10-2 M, người ta xác định được nồng độ H+ bằng 8,6.10-4 mol/l. Hỏi có bao nhiêu phần trăm phân tử CH3COOH trong dung dịch này điện li ra ion?
Lời giải:
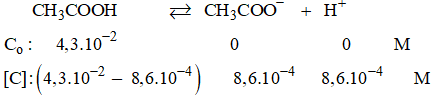
Phần trăm phân tử CH3COOH phân li ra ion là:
Chú ý: Co: Nồng độ ban đầu, [C] nồng độ cân bằng.
Xem thêm lời giải sách bài tập Hóa học lớp 11 hay, chi tiết khác:
Bài 1.2 trang 3 sbt Hóa 11: Dung dịch nào dưới đây dẫn điện tốt nhất?...
Bài 1.3 trang 3 sbt Hóa 11: Trong bốn chất sau, chất nào là chất điện li yếu?...
Bài 1.6 trang 3 Sbt Hóa 11: Viết phương trình điện li của axit yếu CH3COOH trong dung dịch...
Trắc nghiệm Sự điện li có đáp án
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 11 (hay nhất) | Để học tốt Ngữ Văn 11 (sách mới)
- Soạn văn 11 (ngắn nhất) | Để học tốt Ngữ văn 11 (sách mới)
- Tác giả tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Văn mẫu 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Toán 11 | Giải bài tập Toán 11 Học kì 1, Học kì 2 (sách mới)
- Các dạng bài tập Toán lớp 11
- Lý thuyết Toán lớp 11 (sách mới) | Kiến thức trọng tâm Toán 11
- Giáo án Toán lớp 11 mới nhất
- Bài tập Toán lớp 11 mới nhất
- Chuyên đề Toán lớp 11 mới nhất
- Giải sgk Tiếng Anh 11 (thí điểm)
- Giải sgk Tiếng Anh 11 | Giải bài tập Tiếng anh 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Tiếng Anh 11 (sách mới) | Sách bài tập Tiếng Anh 11
- Giải sbt Tiếng Anh 11 (thí điểm)
- Giải sgk Lịch sử 11 | Giải bài tập Lịch sử 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Lịch Sử 11(sách mới) | Kiến thức trọng tâm Lịch Sử 11
- Giải Tập bản đồ Lịch sử 11
- Giải sgk Vật Lí 11 | Giải bài tập Vật lí 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 11 (sách mới) | Sách bài tập Vật Lí 11
- Lý thuyết Vật Lí 11 (sách mới) | Kiến thức trọng tâm Vật Lí 11
- Các dạng bài tập Vật Lí lớp 11
- Giáo án Vật lí lớp 11 mới nhất
- Giải sgk Sinh học 11 | Giải bài tập Sinh học 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Sinh học 11 (sách mới) | Kiến thức trọng tâm Sinh 11
- Giải sgk Giáo dục công dân 11
- Lý thuyết Giáo dục công dân 11
- Lý thuyết Địa Lí 11 (sách mới) | Kiến thức trọng tâm Địa lí 11
- Giải Tập bản đồ Địa Lí 11
- Giải sgk Giáo dục quốc phòng - an ninh 11
