Giải KHTN 8 Bài 9 (Chân trời sáng tạo): Acid
Với lời giải bài tập Khoa học tự nhiên lớp 8 Bài 9: Acid sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi và làm bài tập KHTN 8 Bài 9.
Giải KHTN 8 Bài 9: Acid
Trả lời:
- Tính chất chung của acid:
+ Các dung dịch acid làm đổi màu giấy quỳ tím thành màu đỏ.
+ Nhiều kim loại (ngoại trừ Cu, Ag, Au, Pt …) khi phản ứng với dung dịch acid sẽ tạo thành muối và giải phóng khí hydrogen.
- Ứng dụng của một số acid:
+ Acetic acid được dùng để: chế tạo dược phẩm, sản xuất tơ nhân tạo, chế tạo chất dẻo, sản xuất phẩm nhuộm, sản xuất thuốc diệt côn trùng, pha chế giấm ăn …
+ Acid H2SO4 và HCl được dùng để: sản xuất phẩm nhuộm, sản xuất chất tẩy rửa, chế biến dầu mỏ, sản xuất acid, chế tạo acquy, chế tạo thuốc nổ, sản xuất tơ sợi, sản xuất phân bón, sản xuất giấy …
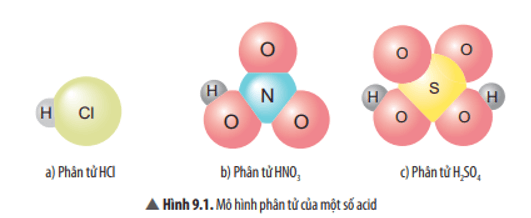
1. Khái niệm acid
Trả lời:
Khi phân tử hydrogen chloride tan trong nước đã xảy ra quá trình:
HCl → H+ + Cl-
Trả lời:
Điểm chung của các chất: đều có nguyên tử H liên kết với gốc acid.
Trả lời:
Các phân tử là acid và có thể tạo ra ion H+ khi tan trong nước: H2SO3, HClO4.
2. Tính chất hoá học của acid
Câu hỏi thảo luận 3 trang 47 KHTN 8: Cho biết sự đổi màu của giấy quỳ tím trong Thí nghiệm 1.
Trả lời:
Giấy quỳ tím chuyển sang màu đỏ.
Luyện tập trang 47 KHTN 8: Bằng cách đơn giản nào ta có thể nhận biết dung dịch có tính acid?
Trả lời:
Bằng cách sử dụng giấy quỳ tím có thể nhận biết dung dịch có tính acid.
Trả lời:
Học sinh tự làm thí nghiệm.
Chú ý: Cả hai trường hợp giấy quỳ tím đều chuyển sang màu đỏ
Trả lời:
Hiện tượng: Mẩu kẽm tan dần, có khí thoát ra.
Sản phẩm tạo thành: ZnCl2, H2.
Trả lời:
Hiện tượng: Lá nhôm tan dần, có khí thoát ra.
Phương trình hoá học: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2.
Trả lời:
Thức ăn có vị chua có môi trường acid, do đó người mắc dạ dày thường được các bác sĩ khuyên không nên sử dụng thức ăn có vị chua.
3. Ứng dụng của một số acid thông dụng
Câu hỏi thảo luận 5 trang 48 KHTN 8: Quan sát Hình 9.4 và 9.5, cho biết một số ứng dụng của acid.
Trả lời:
- Ứng dụng của một số acid:
+ Acetic acid được dùng để: chế tạo dược phẩm, sản xuất tơ nhân tạo, chế tạo chất dẻo, sản xuất phẩm nhuộm, sản xuất thuốc diệt côn trùng, pha chế giấm ăn …
+ Acid H2SO4 và HCl được dùng để: sản xuất phẩm nhuộm, sản xuất chất tẩy rửa, chế biến dầu mỏ, sản xuất acid, chế tạo acquy, chế tạo thuốc nổ, sản xuất tơ sợi, sản xuất phân bón, sản xuất giấy …
Trả lời:
Thành phần của giấm ăn có chứa: Acetic acid.
Một số ứng dụng của giấm ăn trong đời sống:
+ Khắc phục bong gân, máu bầm ...
+ Kiểm soát lượng đường trong máu.
+ Hỗ trợ hấp thu các chất dinh dưỡng khác.
+ Lưu giữ mùi vị và màu sắc món ăn.
+ Tẩy vết cặn ở bồn rửa, ấm đun nước …
Kiến thức trọng tâm KHTN 8 Bài 9: Acid
I. Khái niệm acid
Acid là những hợp chất mà trong phân tử có một hay nhiều nguyên tử hydrogen liên kết với gốc acid. Khi tan trong nước, acid tạo ra ion H+ (ion hydrogen).
Ví dụ, khí hydrogen chloride (HCl) khi tan vào nước sẽ xảy ra quá trình:
HCl → H+ + Cl-
Vì vậy trong nước, HCl được gọi là hydrochloric acid.
Tên gọi một số acid và gốc acid tương ứng được thể hiện trong bảng sau:
|
Acid |
Tên acid |
Gốc acid |
Tên gốc acid |
Hoá trị gốc acid |
|
HCl |
Hydrochloric acid |
−Cl |
chloride |
I |
|
H2S |
Hydrosulfuric acid |
=S |
sulfide |
II |
|
H2SO3 |
Sulfurous acid |
=SO3 |
sulfite |
II |
|
HNO3 |
Nitric acid |
−NO3 |
nitrate |
I |
|
H2SO4 |
Sulfuric acid |
=SO4 |
sulfate |
II |
|
H3PO4 |
Phosphoric acid |
≡PO4 |
phosphate |
III |
|
CH3COOH |
Acetic acid |
CH3COO− |
acetate |
I |
II. Tính chất hoá học của acid
1. Acid làm đổi màu chất chỉ thị
Các dung dịch acid làm đổi màu giấy quỳ tím thành màu đỏ.
Quỳ tím là chất chỉ thị màu dùng để nhận biết dung dịch acid.
Dung dịch HCl làm quỳ tím đổi màu
2. Acid tác dụng với kim loại
Nhiều kim loại (ngoại trừ Cu, Ag, Au, Pt, …) khi phản ứng với dung dịch acid sẽ tạo thành muối và giải phóng khí hydrogen.
Ví dụ:
Zn + 2HCl → ZnCl2 + H2
2Al + 6HCl → 2AlCl3 + 3H2
Mở rộng
- Acid dạ dày rất cần cho việc tiêu hoá thức ăn. Tuy nhiên nếu dư thừa acid có thể tăng nguy cơ các vấn đề khác như trào ngược, viêm loét, xuất huyết dạ dày, … thậm chí là ung thư dạ dày.
- Hiện tượng mưa acid là một trong những hiện tượng tự nhiên. Quá trình đốt nhiên liệu sinh ra các khí độc hại như SO2 và NO2. Các phản ứng hoá học xảy ra khi các khí SO2 và NO2 hoà tan trong hơi nước của không khí tạo thành H2SO4 và HNO3. Các phân tử này hoà tan trong nước mưa tạo thành acid và rơi xuống khi trời mưa. Mưa acid sẽ phá huỷ các vật liệu làm bằng kim loại, làm giảm tuổi thọ các công trình xây dựng, làm hỏng bề mặt bằng đá của các công trình xây dựng, di tích lịch sử.
III. Ứng dụng của một số acid thông dụng
- Từ acetic acid (CH3COOH), người ta có thể chế tạo ra được các sản phẩm phục vụ đời sống như:
- Mỗi năm có khoảng 160 triệu tấn sulfuric acid (H2SO4) và hydrochloric acid (HCl) được sử dụng, trong đó việc tiêu thụ acid cho các ngành sản xuất như phân bón chiếm 30%; chất tẩy rửa 14%; giấy, tơ sợi 8%; phẩm nhuộm 2%...
Một số ứng dụng của H2SO4 và HCl được thể hiện trong ảnh sau:
Xem thêm lời giải bài tập Khoa học tự nhiên lớp 8 Chân trời sáng tạo hay, chi tiết khác:
Xem thêm các chương trình khác:
- Soạn văn lớp 8 Chân trời sáng tạo (hay nhất)
- Văn mẫu lớp 8 - Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn 8 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn lớp 8 – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 8 - Chân trời sáng tạo
- Giải SBT Ngữ văn 8 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 8 – Chân trời sáng tạo
- Soạn văn 8 Chân trời sáng tạo (ngắn nhất)
- Giải sgk Toán 8 – Chân trời sáng tạo
- Lý thuyết Toán 8 – Chân trời sáng tạo
- Giải sbt Toán 8 – Chân trời sáng tạo
- Giải sgk Tiếng Anh 8 – Friends Plus
- Giải sbt Tiếng Anh 8 - Friends plus
- Trọn bộ Từ vựng Tiếng Anh 8 Friends plus đầy đủ nhất
- Trọn bộ Ngữ pháp Tiếng Anh 8 Friends plus đầy đủ nhất
- Giải sgk Lịch sử 8 – Chân trời sáng tạo
- Lý thuyết Lịch sử 8 - Chân trời sáng tạo
- Giải sbt Lịch sử 8 – Chân trời sáng tạo
- Giải sgk Địa lí 8 – Chân trời sáng tạo
- Lý thuyết Địa lí 8 - Chân trời sáng tạo
- Giải sbt Địa lí 8 – Chân trời sáng tạo
- Giải sgk Giáo dục công dân 8 – Chân trời sáng tạo
- Lý thuyết Giáo dục công dân 8 – Chân trời sáng tạo
- Giải sbt Giáo dục công dân 8 – Chân trời sáng tạo
- Giải sgk Công nghệ 8 – Chân trời sáng tạo
- Lý thuyết Công nghệ 8 - Chân trời sáng tạo
- Giải sbt Công nghệ 8 – Chân trời sáng tạo
- Giải sgk Tin học 8 – Chân trời sáng tạo
- Lý thuyết Tin học 8 - Chân trời sáng tạo
- Giải sbt Tin học 8 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 8 – Chân trời sáng tạo