Giải KHTN 8 Bài 12 (Chân trời sáng tạo): Oxide
Với lời giải bài tập Khoa học tự nhiên lớp 8 Bài 12: Oxide sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi và làm bài tập KHTN 8 Bài 12.
Giải KHTN 8 Bài 12: Oxide
Trả lời:
- Oxide là hợp chất gồm hai nguyên tố, trong đó có nguyên tố oxygen.
- Có 4 loại oxide:
+ Oxide acid là oxide phản ứng được với dung dịch base tạo thành muối và nước.
+ Oxide base là oxide phản ứng được với dung dịch acid tạo thành muối và nước.
+ Oxide lưỡng tính là oxide vừa phản ứng được với dung dịch acid, vừa phản ứng với dung dịch base.
+ Oxide trung tính là các oxide không phản ứng với dung dịch acid, không phản ứng với dung dịch base.
- Có những oxide có sẵn trong tự nhiên, có những oxide không có sẵn trong tự nhiên con người điều chế ra.
1. Khái niệm oxide – phương trình hoá học tạo ra oxide
Câu hỏi thảo luận 1 trang 56 KHTN 8: Thành phần của các chất ở Hình 12.1 có đặc điểm gì giống nhau?
Trả lời:
Điểm giống nhau: Các hợp chất này đều gồm 2 nguyên tố, trong đó có 1 nguyên tố là oxygen.
Trả lời:
Chất là oxide: ZnO; SiO2; Fe2O3; Cl2O7.
Trả lời:
- Ứng dụng của iron(II) oxide: dùng điều chế Fe3O4, muối Fe(II) …
- Ứng dụng của iron (III) oxide: dùng để luyện gang, pha sơn chống gỉ…
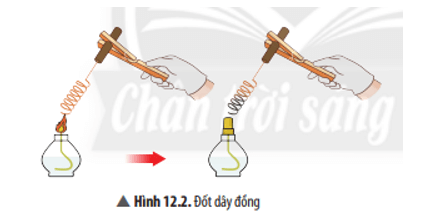
Câu hỏi thảo luận 2 trang 57 KHTN 8: Viết phương trình hoá học của phản ứng ở Ví dụ 2.
Trả lời:
Phương trình hoá học: 2Cu + O2 to→ 2CuO.
Câu hỏi thảo luận 3 trang 57 KHTN 8: Viết phương trình hoá học của phản ứng xảy ra ở Ví dụ 4.
Trả lời:
Phương trình hoá học: C + O2 to→ CO2.
Trả lời:
4Na + O2 → 2Na2O
S + O2 to→SO2
2Zn + O2 to→2ZnO.
Trả lời:
Một số oxide có trong quặng bauxite: Al2O3; Fe2O3; SiO2 …
Ứng dụng của aluminium oxide: sản xuất nhôm. Ngoài ra, tinh thể Al2O3 được dùng làm đồ trang sức, chế tạo các chi tiết trong các ngành kĩ thuật chính xác, như chân kính đồng hồ, thiết bị phát tia laser … Bột Al2O3 có độ cứng cao được dùng làm vật liệu mài...
2. Phân loại oxide
Trả lời:
Giấm ăn có tính acid nên có thể phản ứng với gỉ sét tạo thành muối tan dễ rửa trôi.
6CH3COOH + Fe2O3 → 2(CH3COO)3Fe + 3H2O.
Trả lời:
Oxide base: Fe2O3; K2O; BaO; CuO; CaO.
Oxide acid: SiO2; SO2; NO2; CO2.
Trả lời:
Các oxide này là oxide lưỡng tính do vừa tan được trong dung dịch HCl (acid), vừa tan được trong dung dịch NaOH (kiềm).
Trả lời:
Khối lượng oxygen có trong (B) là: 80.60100=48(amu).
Số nguyên tử oxygen trong (B) là: 48 : 16 = 3 (nguyên tử).
Khối lượng nguyên tử còn lại trong (B) là: 80 – 48 = 32 (amu).
Vậy (B) là SO3, đây là oxide acid.
3. Tính chất hoá học của oxide
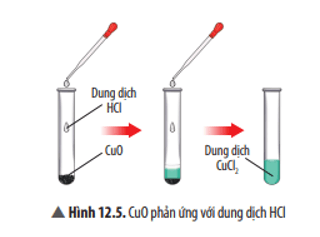
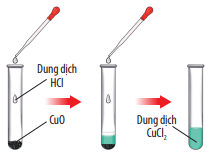
Trả lời:
Hiện tượng: CuO tan dần, sau phản ứng thu được dung dịch có màu xanh.
Phương trình hoá học: CuO + 2HCl → CuCl2 + H2O.
Nếu thay HCl bằng H2SO4 thì phản ứng vẫn diễn ra, do CuO là oxide base nên tác dụng được với H2SO4 là acid.
Trả lời:
a) CaO + 2HCl → CaCl2 + H2O
b) MgO + H2SO4 → MgSO4 + H2O
c) FeO + 2HCl → FeCl2 + H2O
d) Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O.
a) Bằng tìm hiểu từ sách, báo và internet, hãy cho biết thêm một số ứng dụng của zinc chloride.
Trả lời:
a) Một số ứng dụng của zinc chloride: được dùng để mạ kẽm lên sắt, bôi vào khuôn trước khi đúc, đánh bóng thép, là hoá chất làm sạch bề mặt kim loại trước khi hàn. Ngoài ra, zinc chloride còn được dùng để làm chất tạo màu trắng trong sơn, chất xúc tác trong công nghiệp chế biến mủ cao su …
b) Phương trình hoá học: ZnO + 2HCl → ZnCl2 + H2O
Tỉ lệ: 1 : 2 : 1 : 1
Theo bài ra: nZnCl2=34136=0,25 (mol);
Theo phương trình hoá học: nZnO=nZnCl2=0,25 (mol).
Khối lượng ZnO cần dùng là: mZnO = 0,25 × 81 = 20,25 gam.
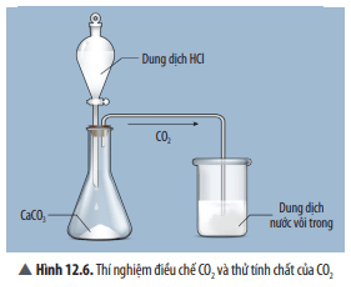
Trả lời:
Hiện tượng: Có kết tủa trắng xuất hiện.
Phương trình hoá học: CO2 + Ca(OH)2 → CaCO3 + H2O.
Trả lời:
- Các oxide phản ứng với KOH là: SO3, P2O5.
Phương trình hoá học minh hoạ:
SO3 + 2KOH → K2SO4 + H2O
P2O5 + 6KOH → 2K3PO4 + 3H2O
- Oxide phản ứng với dung dịch HCl là: MgO
Phương trình hoá học minh hoạ:
MgO + 2HCl → MgCl2 + H2O.
a) Viết phương trình hoá học của phản ứng.
Trả lời:
a) Phương trình hoá học của phản ứng:
CO2 + NaOH → NaHCO3.
b) Theo bài ra: nNaHCO3=42084=5 (mol)
Theo phương trình hoá học: nCO2=nNaOH=nNaHCO3
Thể tích carbon dioxide (đkc) cần dùng là:
VCO2=5×24,79=123,95(L).
Khối lượng sodium hydroxide cần dùng là:
mNaOH = 5 × 40 = 200 (gam).
Kiến thức trọng tâm KHTN 8 Bài 12: Oxide
I. Khái niệm oxide – phương trình hoá học tạo oxide
1. Khái niệm oxide
Oxide là hợp chất gồm 2 nguyên tố, trong đó có nguyên tố oxygen.
Công thức hoá học chung của oxide là MxOy.
Một số oxide trong tự nhiên có nhiều ứng dụng vào đời sống:
+ Silicon dioxide (SiO2) là thành phần chính của cát, nguyên liệu trong sản xuất thuỷ tinh, vật liệu silicate, …
+ Aluminium oxide (Al2O3) là thành phần chính của quặng bauxite, nguyên liệu trong điều chế aluminium.
+ Carbon dioxide (CO2) có trong thành phần không khí, là nguyên liệu cho quá trình quang hợp của thực vật.
2. Tìm hiểu phản ứng tạo oxide
Các phản ứng hoá học tạo ra oxide:
- Kim loại phản ứng với oxygen:
Kim loại + O2 to→Oxide kim loại
Phản ứng trên xảy ra với hầu hết các kim loại (trừ Au, Pt, Ag).
Chú ý:
Ở nhiệt độ thường, một số kim loại phản ứng chậm với oxygen trong không khí tạo thành một lớp oxide bao quanh bề mặt kim loại:
+ Sắt để lâu trong không khí sẽ bị gỉ sét.
+ Đồ dùng bằng nhôm tự tạo lớp oxide bao quanh bên ngoài, lớp oxide này có tác dụng bảo vệ nhôm.
- Phi kim phản ứng với oxygen:
Phi kim + O2 to→ Oxide phi kim
Các phi kim thường gặp: C, S, P, …
II. Phân loại oxide
Có 4 loại oxide:
- Oxide acid là loại oxide phản ứng được với dung dịch base tạo ra muối và nước.
Ví dụ: CO2, SO2, SO3 …
- Oxide base là loại oxide phản ứng được với dung dịch acid tạo ra muối và nước.
Ví dụ: CaO, BaO, Na2O …
- Oxide lưỡng tính là các oxide vừa phản ứng được với dung dịch acid vừa phản ứng được với dung dịch base đều tạo ra muối và nước.
Ví dụ: Al2O3, ZnO …
- Oxide trung tính là các oxide không phản ứng được với dung dịch acid và dung dịch base.
Ví dụ: CO, NO…
Các oxide trung tính thường là các oxide của nguyên tố phi kim có hoá trị trong oxide < IV và không có acid tương ứng.
III. Tính chất hoá học của oxide
1. Oxide base phản ứng với dung dịch acid
Oxide base phản ứng với dung dịch acid tạo ra muối của acid tương ứng và nước.
Ví dụ:
ZnO + H2SO4 → ZnSO4 + H2O
CuO + 2HCl → CuCl2 + H2O
CuO phản ứng với dung dịch HCl
2. Oxide acid phản ứng với dung dịch base
Oxide acid phản ứng với dung dịch base tạo ra muối của acid tương ứng và nước.
Ví dụ:
SO2 + 2NaOH → Na2SO3 + H2O
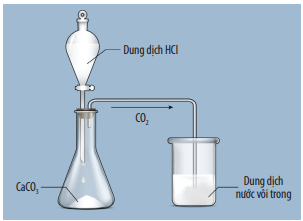
CO2 + Ca(OH)2 → CaCO3 + H2O
Thí nghiệm điều chế và thử tính chất của CO2
Mở rộng:
Oxide acid phản ứng với dung dịch base tạo muối có thành phần gồm kim loại trong base và gốc acid tương ứng của oxide acid theo bảng sau:
|
Oxide acid |
Kí hiệu gốc acid |
Tên kí hiệu gốc acid |
Hoá trị |
|
CO2 |
=CO3 |
Carbonate |
II |
|
CO2 |
−HCO3 |
Hydrogen carbonate |
I |
|
SO2 |
=SO3 |
Sulfite |
II |
|
SO2 |
−HSO3 |
Hydrogen sulfite |
I |
|
SO3 |
=SO4 |
Sulfate |
II |
|
P2O5 |
≡PO4 |
Phosphate |
III |
Xem thêm lời giải bài tập Khoa học tự nhiên lớp 8 Chân trời sáng tạo hay, chi tiết khác:
Xem thêm các chương trình khác:
- Soạn văn lớp 8 Chân trời sáng tạo (hay nhất)
- Văn mẫu lớp 8 - Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn 8 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn lớp 8 – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 8 - Chân trời sáng tạo
- Giải SBT Ngữ văn 8 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 8 – Chân trời sáng tạo
- Soạn văn 8 Chân trời sáng tạo (ngắn nhất)
- Giải sgk Toán 8 – Chân trời sáng tạo
- Lý thuyết Toán 8 – Chân trời sáng tạo
- Giải sbt Toán 8 – Chân trời sáng tạo
- Giải sgk Tiếng Anh 8 – Friends Plus
- Giải sbt Tiếng Anh 8 - Friends plus
- Trọn bộ Từ vựng Tiếng Anh 8 Friends plus đầy đủ nhất
- Trọn bộ Ngữ pháp Tiếng Anh 8 Friends plus đầy đủ nhất
- Giải sgk Lịch sử 8 – Chân trời sáng tạo
- Lý thuyết Lịch sử 8 - Chân trời sáng tạo
- Giải sbt Lịch sử 8 – Chân trời sáng tạo
- Giải sgk Địa lí 8 – Chân trời sáng tạo
- Lý thuyết Địa lí 8 - Chân trời sáng tạo
- Giải sbt Địa lí 8 – Chân trời sáng tạo
- Giải sgk Giáo dục công dân 8 – Chân trời sáng tạo
- Lý thuyết Giáo dục công dân 8 – Chân trời sáng tạo
- Giải sbt Giáo dục công dân 8 – Chân trời sáng tạo
- Giải sgk Công nghệ 8 – Chân trời sáng tạo
- Lý thuyết Công nghệ 8 - Chân trời sáng tạo
- Giải sbt Công nghệ 8 – Chân trời sáng tạo
- Giải sgk Tin học 8 – Chân trời sáng tạo
- Lý thuyết Tin học 8 - Chân trời sáng tạo
- Giải sbt Tin học 8 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 8 – Chân trời sáng tạo