Giải KHTN 8 Bài 4 (Chân trời sáng tạo): Định luật bảo toàn khối lượng và phương trình hoá học
Với lời giải bài tập Khoa học tự nhiên lớp 8 Bài 4: Định luật bảo toàn khối lượng và phương trình hoá học sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi và làm bài tập KHTN 8 Bài 4.
Giải KHTN 8 Bài 4: Định luật bảo toàn khối lượng và phương trình hoá học
Trả lời:
- Khi một phản ứng hoá học xảy ra, tổng khối lượng các chất trước và sau phản ứng không thay đổi.
- Để thuận tiện cho việc trình bày ngắn gọn một phản ứng hoá học, người ta sử dụng các công thức hoá học biểu diễn cho các chất, gọi là phương trình hoá học.
1. Định luật bảo toàn khối lượng
Trả lời:
Ban đầu cả dung dịch đều trong suốt, không có màu.
Trả lời:
Sau khi rót cốc (1) vào cốc (2):
+ Hiện tượng: có kết tủa trắng xuất hiện.
+ Dấu hiệu có phản ứng hoá học xảy ra: có kết tủa trắng xuất hiện.
Trả lời:
Tổng khối lượng của 2 cốc trước và sau phản ứng không thay đổi.
Trả lời:
Trong phản ứng hoá học diễn ra sự thay đổi liên kết giữa các nguyên tử còn số nguyên tử mỗi nguyên tố vẫn giữ nguyên và khối lượng của các nguyên tử không đổi, vì vậy tổng khối lượng các chất được bảo toàn.
2. Phương trình hoá học
Trả lời:
Phương trình hoá học biểu diễn phản ứng hoá học bằng công thức hoá học của chất tham gia và chất sản phẩm.
Trả lời:
Sơ đồ phản ứng dạng chữ:
Khí hydrogen + khí oxygen → nước.
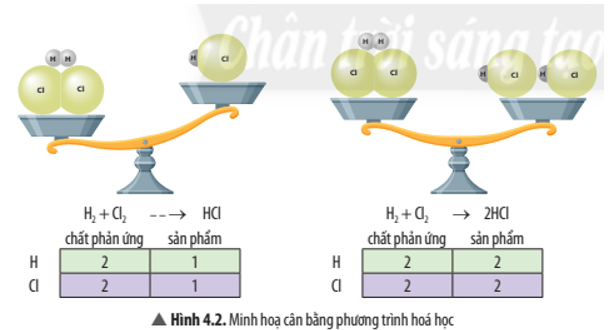
Trả lời:
Phương trình được cân bằng là: H2 + Cl2 → 2HCl
Do số nguyên tử của mỗi nguyên tố ở hai vế của phương trình là bằng nhau.
Trả lời:
Sơ đồ phản ứng (*): P + O2 → P2O5.
- Ở vế trái: P + O2
+ Có 1 nguyên tử P và 2 nguyên tử O.
+ Số nguyên tử O lớn hơn.
- Ở vế phải: P2O5
+ Có 2 nguyên tử P và 5 nguyên tử O.
+ Số nguyên tử O lớn hơn
Câu hỏi thảo luận 7 trang 26 KHTN 8: Để cân bằng, bắt đầu cân bằng từ nguyên tố nào trước?
Trả lời:
Để cân bằng, bắt đầu cân bằng từ nguyên tố O trước.
Trả lời:
Ta làm chẵn số nguyên tử O vế phải bằng cách đặt hệ số 2 trước P2O5:
P + O2 → 2P2O5.
Để số nguyên tử O vế trái bằng với vế phải, ta thêm hệ số 5:
P + 5O2 → 2P2O5.
Câu hỏi thảo luận 9 trang 26 KHTN 8: Phương trình hoá học cho biết những thông tin gì?
Trả lời:
Phương trình hoá học cho biết tỉ lệ về số nguyên tử hoặc số phân tử giữa các chất trong phản ứng.
a) Na + O2 → Na2O
b) Na2CO3 + Ba(OH)2 → NaOH + BaCO3
c) Fe + O2 → Fe3O4
Trả lời:
a) Bước 1: Viết sơ đồ phản ứng:
Na + O2 → Na2O
Bước 2: Làm chẵn số nguyên tử O vế phải bằng cách đặt hệ số 2 trước Na2O.
Na + O2 → 2Na2O
Số nguyên tử Na vế trái và phải chưa bằng nhau, ta đặt hệ số 4 trước Na.
4Na + O2 → 2Na2O
Bước 3: Viết phương trình hoá học hoàn chỉnh:
4Na + O2 → 2Na2O
Tỉ lệ: 4 nguyên tử Na : 1 phân tử O2 : 2 phân tử Na2O.
Hay cứ 4 nguyên tử Na tác dụng với 1 phân tử O2 tạo ra 2 phân tử Na2O.
b) Bước 1: Viết sơ đồ phản ứng
Na2CO3 + Ba(OH)2 → NaOH + BaCO3
Bước 2: Số nhóm (OH) ở vế phải và vế trái chưa bằng nhau, ta đặt hệ số 2 trước NaOH.
Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3
Bước 3: Viết phương trình hoá học hoàn chỉnh:
Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3
Tỉ lệ: 1 phân tử Na2CO3 : 1 phân tử Ba(OH)2 : 2 phân tử NaOH : 1 phân tử BaCO3.
Hay cứ 1 phân tử Na2CO3 tác dụng với 1 phân tử Ba(OH)2 tạo ra 2 phân tử NaOH và 1 phân tử BaCO3.
c) Bước 1: Viết sơ đồ phản ứng:
Fe + O2 → Fe3O4
Bước 2: Số nguyên tử O ở vế phải và vế trái chưa bằng nhau, ta thêm hệ số 2 vào O2:
Fe + 2O2 → Fe3O4
Số nguyên tử Fe ở vế trái và vế phải chưa bằng nhau, ta thêm hệ số 3 vào Fe:
3Fe + 2O2 → Fe3O4
Bước 3: Viết phương trình hoá học hoàn chỉnh:
3Fe + 2O2 → Fe3O4
Tỉ lệ: 3 nguyên tử Fe : 2 phân tử O2 : 1 phân tử Fe3O4.
Hay cứ 3 nguyên tử Fe tác dụng với 2 phân tử O2 được 1 phân tử Fe3O4.
Trả lời:
Bước 1: Viết sơ đồ phản ứng:
Al + O2 → Al2O3
Bước 2: Ta làm chẵn số nguyên tử O vế phải bằng cách thêm 2 vào Al2O3:
Al + O2 → 2Al2O3
Để số nguyên tử O vế trái bằng vế phải, ta thêm hệ số 3 vào O2:
Al + 3O2 → 2Al2O3
Số nguyên tử Al vế trái chưa bằng vế phải, ta thêm hệ số 4 vào Al:
4Al + 3O2 → 2Al2O3
Bước 3: Viết phương trình hoá học hoàn chỉnh:
4Al + 3O2 → 2Al2O3
Người ta thường dùng nhôm để chế tạo đồ dùng và dụng cụ nhà bếp do nhôm bền, nhẹ, dẫn nhiệt tốt.
Kiến thức trọng tâm KHTN 8 Bài 4: Định luật bảo toàn khối lượng và phương trình hoá học
I. Định luật bảo toàn khối lượng
Trong một phản ứng hoá học, tổng khối lượng của các chất sản phẩm bằng tổng khối lượng của các chất tham gia phản ứng.
Giải thích:
Trong phản ứng hoá học, diễn ra sự thay đổi liên kết giữa các nguyên tử, còn số nguyên tử của mỗi nguyên tố vẫn giữ nguyên và khối lượng của các nguyên tử không đổi, vì vậy tổng khối lượng các chất được bảo toàn.
II. Phương trình hoá học
1. Tìm hiểu phương trình hoá học
Sơ đồ tổng quát của một phản ứng:
Chất phản ứng → Sản phẩm
Để thuận tiện cho việc trình bày ngắn gọn một phản ứng hoá học, người ta sử dụng các công thức hoá học biểu diễn cho các chất, gọi là phương trình hoá học.
Khi chuyển từ sơ đồ phản ứng thành phương trình hoá học, ta cần chú ý:
+ Viết đúng công thức hoá học cho tất cả các chất.
+ Sắp xếp theo đúng vị trí công thức hoá học của chất phản ứng và sản phẩm.
+ Liên kết các công thức hoá học bằng dấu + và kí hiệu → để được một phương trình hoá học hoàn chỉnh.
Ví dụ:
Phản ứng hoá học giữa đinh sắt (iron, Fe) và dung dịch sulfuric acid (H2SO4) tạo ra iron(II) sulfate (FeSO4) và khí hydrogen (H2).
Ta biểu diễn thành sơ đồ phản ứng dạng chữ như sau:
Iron + Sulfuric acid → Iron(II) sulfate + Hydrogen
Thay tên các chất bằng công thức hoá học, được sơ đồ phản ứng:
Fe + H2SO4 → FeSO4 + H2↑
2. Các bước lập phương trình hoá học
Một phương trình hoá học được xem là cân bằng khi nó thoả mãn định luật bảo toàn khối lượng, tức là số nguyên tử của mỗi nguyên tố ở hai vế phương trình phải bằng nhau.
Để lập phương trình hoá học hay còn gọi là cân bằng số nguyên tử của các chất trong phản ứng, ta tiến hành theo 3 bước:
Bước 1: Viết sơ đồ phản ứng.
Bước 2: Cân bằng số nguyên tử của mỗi nguyên tố.
Bước 3: Viết phương trình hoá học hoàn chỉnh.
Lưu ý:
+ Không được thay đổi chỉ số trong những công thức hoá học đã viết đúng. Ví dụ không thay 5O2 thành 10O.
+ Nếu trong công thức hoá học có nhóm nguyên tử (ví dụ nhóm (OH), nhóm (SO4), …) ta xem cả nhóm như một đơn vị để cân bằng.
3. Ý nghĩa của phương trình hoá học
Phương trình hoá học cho biết tỉ lệ về số nguyên tử hoặc số phân tử giữa các chất trong phản ứng. Tỉ lệ này đúng bằng tỉ lệ hệ số mỗi chất trong phương trình.
Xem thêm lời giải bài tập Khoa học tự nhiên lớp 8 Chân trời sáng tạo hay, chi tiết khác:
Bài 5: Mol và tỉ khối của chất khí
Bài 6: Tính theo phương trình hoá học
Xem thêm các chương trình khác:
- Soạn văn lớp 8 Chân trời sáng tạo (hay nhất)
- Văn mẫu lớp 8 - Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn 8 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn lớp 8 – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 8 - Chân trời sáng tạo
- Giải SBT Ngữ văn 8 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 8 – Chân trời sáng tạo
- Soạn văn 8 Chân trời sáng tạo (ngắn nhất)
- Giải sgk Toán 8 – Chân trời sáng tạo
- Lý thuyết Toán 8 – Chân trời sáng tạo
- Giải sbt Toán 8 – Chân trời sáng tạo
- Giải sgk Tiếng Anh 8 – Friends Plus
- Giải sbt Tiếng Anh 8 - Friends plus
- Trọn bộ Từ vựng Tiếng Anh 8 Friends plus đầy đủ nhất
- Trọn bộ Ngữ pháp Tiếng Anh 8 Friends plus đầy đủ nhất
- Giải sgk Lịch sử 8 – Chân trời sáng tạo
- Lý thuyết Lịch sử 8 - Chân trời sáng tạo
- Giải sbt Lịch sử 8 – Chân trời sáng tạo
- Giải sgk Địa lí 8 – Chân trời sáng tạo
- Lý thuyết Địa lí 8 - Chân trời sáng tạo
- Giải sbt Địa lí 8 – Chân trời sáng tạo
- Giải sgk Giáo dục công dân 8 – Chân trời sáng tạo
- Lý thuyết Giáo dục công dân 8 – Chân trời sáng tạo
- Giải sbt Giáo dục công dân 8 – Chân trời sáng tạo
- Giải sgk Công nghệ 8 – Chân trời sáng tạo
- Lý thuyết Công nghệ 8 - Chân trời sáng tạo
- Giải sbt Công nghệ 8 – Chân trời sáng tạo
- Giải sgk Tin học 8 – Chân trời sáng tạo
- Lý thuyết Tin học 8 - Chân trời sáng tạo
- Giải sbt Tin học 8 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 8 – Chân trời sáng tạo