Giải KHTN 8 Bài 8 (Chân trời sáng tạo): Tốc độ phản ứng và chất xúc tác
Với lời giải bài tập Khoa học tự nhiên lớp 8 Bài 8: Tốc độ phản ứng và chất xúc tác sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi và làm bài tập KHTN 8 Bài 8.
Giải KHTN 8 Bài 8: Tốc độ phản ứng và chất xúc tác
Trả lời:
- Tốc độ phản ứng là đại lượng chỉ mức độ nhanh hay chậm của một phản ứng hoá học.
- Các yếu tố ảnh hưởng đến tốc độ phản ứng: nồng độ chất phản ứng, nhiệt độ phản ứng, diện tích tiếp xúc, chất xúc tác.
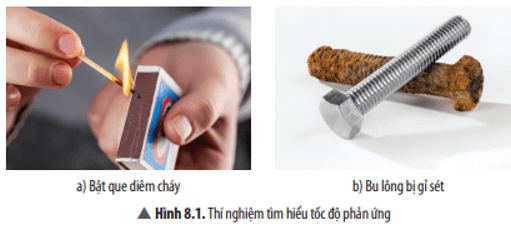
1. Tốc độ phản ứng hoá học
Trả lời:
- Hiện tượng que diêm cháy diễn ra nhanh.
- Hiện tượng bu lông bị gỉ sét diễn ra chậm.
Trả lời:
Các phản ứng hoá học khác nhau thì thời gian phản ứng cũng khác nhau.
2. Các yếu tố ảnh hưởng đến tốc độ phản ứng
Câu hỏi thảo luận 3 trang 40 KHTN 8: Ống nghiệm nào có hiện tượng sủi bọt khí nhanh hơn? Giải thích.
Trả lời:
Ống nghiệm (2) có hiện tượng sủi bọt khí nhanh hơn, do nồng độ H2SO4 ở ống nghiệm (2) là 2M cao hơn nồng độ H2SO4 ở ống nghiệm (1) là 0,1M.
Trả lời:
Nồng độ chất phản ứng càng lớn thì tốc độ phản ứng càng tăng. Do nồng độ các chất phản ứng tăng làm tăng số va chạm có hiệu quả nên tốc độ phản ứng tăng
Trả lời:
Quạt càng mạnh càng làm tăng nồng độ oxygen không khí do đó lửa cháy càng to.
Trả lời:
Tốc độ thoát khí ở hai ống nghiệm là khác nhau. Cụ thể ống nghiệm (1) được đun nóng khí thoát ra nhanh và mạnh hơn, do tốc độ phản ứng lớn hơn.
Câu hỏi thảo luận 6 trang 40 KHTN 8: Nhiệt độ ảnh hưởng như thế nào đến tốc độ phản ứng?
Trả lời:
Nhiệt độ tăng sẽ làm cho các nguyên tử hay phân tử chất chuyển động nhanh hơn, gia tăng sự va chạm, tốc độ phản ứng tăng.
Trả lời:
Theo em, viên thuốc sủi sẽ tan nhanh hơn trong cốc nước nóng. Do nhiệt độ tăng sẽ làm cho các nguyên tử hay phân tử chất chuyển động nhanh hơn, gia tăng sự va chạm, tốc độ phản ứng tăng.
Câu hỏi thảo luận 7 trang 41 KHTN 8: Ống nghiệm nào có lượng khí thoát ra nhanh hơn? Giải thích.
Trả lời:
Ống nghiệm (2) có lượng khí thoát ra nhanh hơn do có tốc độ phản ứng lớn hơn.
Trả lời:
Tốc độ phản ứng sẽ phụ thuộc vào diện tích tiếp xúc của các chất tham gia. Tốc độ phản ứng sẽ tăng lên nếu tăng diện tích bề mặt của chất tham gia bằng cách nghiền nhỏ, đập phẳng hoặc cắt thành nhiều mảnh.
Trả lời:
Ống nghiệm (2) sinh ra khí oxygen sớm hơn để làm que đóm bùng cháy trở lại.
Trả lời:
MnO2 là chất xúc tác, có tác dụng làm cho phản ứng diễn ra nhanh hơn (tăng tốc độ phản ứng) so với không dùng chất xúc tác.
3. Ứng dụng thực tiễn của tốc độ phản ứng
Trả lời:
a) Chẻ nhỏ củi để nhóm lửa dễ hơn: yếu tố diện tích tiếp xúc.
b) Bảo quản thực phẩm bằng tủ lạnh: yếu tố nhiệt độ.
c) Dùng quạt để nhóm lửa: yếu tố nồng độ.
Trả lời:
Khi sản xuất pháo hoa người ta thường sử dụng các nguyên liệu ở dạng bột để tăng diện tích tiếp xúc giữa các chất phản ứng, giúp phản ứng diễn ra nhanh hơn.
Kiến thức trọng tâm KHTN 8 Bài 8: Tốc độ phản ứng và chất xúc tác
I. Tốc độ phản ứng hoá học
Tốc độ phản ứng là đại lượng chỉ mức độ nhanh hay chậm của một phản ứng hoá học.
Ví dụ:
Tốc độ phản ứng cháy của que diêm nhanh hơn tốc độ phản ứng gỉ sét của bu lông.
II. Các yếu tố ảnh hưởng đến tốc độ phản ứng
Nồng độ chất phản ứng, nhiệt độ phản ứng, diện tích tiếp xúc, chất xúc tác là những yếu tố chính ảnh hưởng đến tốc độ phản ứng hoá học.
1. Ảnh hưởng của nồng độ đến tốc độ phản ứng
Khi tăng nồng độ của một hoặc nhiều chất phản ứng thường sẽ làm tăng tốc độ phản ứng.
Ví dụ: Thí nghiệm của Mg với dung dịch H2SO4 với nồng độ khác nhau:
 |
 |
|
Mg và H2SO4 0,1 M |
Mg và H2SO4 2,0 M |
2. Ảnh hưởng của nhiệt độ đến tốc độ phản ứng
Nhiệt độ tăng sẽ làm cho các nguyên tử hay phân tử chất phản ứng chuyển động nhanh hơn, gia tăng sự va chạm, tốc độ phản ứng tăng.
Ví dụ: Thí nghiệm của Zn với dung dịch H2SO4 với nhiệt độ phản ứng khác nhau:
3. Ảnh hưởng của diện tích tiếp xúc đến tốc độ phản ứng
Tốc độ phản ứng sẽ phụ thuộc vào diện tích tiếp xúc của các chất tham gia. Tốc độ phản ứng sẽ tăng lên nếu tăng diện tích bề mặt của chất tham gia bằng cách nghiền nhỏ, đập phẳng hoặc cắt thành nhiều mảnh.
Ví dụ: Thí nghiệm của đá vôi với dung dịch HCl
4. Ảnh của của chất xúc tác đến tốc độ phản ứng
Một trong những cách làm tăng tốc độ phản ứng là thêm chất xúc tác vào chất tham gia.
Chất xúc tác là chất làm tăng tốc độ phản ứng nhưng không bị thay đổi cả về chất và lượng sau phản ứng.
Các chất xúc tác rất quan trọng đối với nhiều phản ứng sinh hoá.
III. Ứng dụng thực tiễn của tốc độ phản ứng
Các yếu tố ảnh hưởng đến tốc độ phản ứng được vận dụng một cách thích hợp sẽ tăng hiệu quả các hoạt động trong đời sống và sản xuất.
Ví dụ:
- Chẻ nhỏ củi để nhóm lửa dễ hơn.
- Bảo quản thực phẩm bằng tủ lạnh để thực phẩm tươi lâu.
- Dùng quạt để nhóm lửa được nhanh hơn.
Xem thêm lời giải bài tập Khoa học tự nhiên lớp 8 Chân trời sáng tạo hay, chi tiết khác:
Xem thêm các chương trình khác:
- Soạn văn lớp 8 Chân trời sáng tạo (hay nhất)
- Văn mẫu lớp 8 - Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn 8 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn lớp 8 – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 8 - Chân trời sáng tạo
- Giải SBT Ngữ văn 8 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 8 – Chân trời sáng tạo
- Soạn văn 8 Chân trời sáng tạo (ngắn nhất)
- Giải sgk Toán 8 – Chân trời sáng tạo
- Lý thuyết Toán 8 – Chân trời sáng tạo
- Giải sbt Toán 8 – Chân trời sáng tạo
- Giải sgk Tiếng Anh 8 – Friends Plus
- Giải sbt Tiếng Anh 8 - Friends plus
- Trọn bộ Từ vựng Tiếng Anh 8 Friends plus đầy đủ nhất
- Trọn bộ Ngữ pháp Tiếng Anh 8 Friends plus đầy đủ nhất
- Giải sgk Lịch sử 8 – Chân trời sáng tạo
- Lý thuyết Lịch sử 8 - Chân trời sáng tạo
- Giải sbt Lịch sử 8 – Chân trời sáng tạo
- Giải sgk Địa lí 8 – Chân trời sáng tạo
- Lý thuyết Địa lí 8 - Chân trời sáng tạo
- Giải sbt Địa lí 8 – Chân trời sáng tạo
- Giải sgk Giáo dục công dân 8 – Chân trời sáng tạo
- Lý thuyết Giáo dục công dân 8 – Chân trời sáng tạo
- Giải sbt Giáo dục công dân 8 – Chân trời sáng tạo
- Giải sgk Công nghệ 8 – Chân trời sáng tạo
- Lý thuyết Công nghệ 8 - Chân trời sáng tạo
- Giải sbt Công nghệ 8 – Chân trời sáng tạo
- Giải sgk Tin học 8 – Chân trời sáng tạo
- Lý thuyết Tin học 8 - Chân trời sáng tạo
- Giải sbt Tin học 8 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 8 – Chân trời sáng tạo