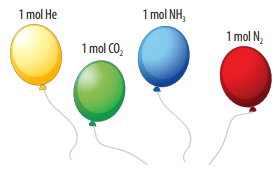Giải KHTN 8 Bài 5 (Chân trời sáng tạo): Mol và tỉ khối của chất khí
Với lời giải bài tập Khoa học tự nhiên lớp 8 Bài 5: Mol và tỉ khối của chất khí sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi và làm bài tập KHTN 8 Bài 5.
Giải KHTN 8 Bài 5: Mol và tỉ khối của chất khí
Trả lời:
Để có thể xác định một cách dễ dàng số nguyên tử, phân tử và khối lượng, thể tích (đối với chất khí) của các chất ta dùng các khái niệm mol, khối lượng mol, thể tích mol chất khí.
1. Mol
Trả lời:
Do nguyên tử hay phân tử của một chất là vô cùng nhỏ nên việc đếm chính xác số nguyên tử hay phân tử trong một lượng chất gần như không thể thực hiện được.
Vận dụng trang 28 KHTN 8: Hãy cho biết 0,25 mol khí O2 có bao nhiêu phân tử oxygen
Trả lời:
1 mol khí O2 có 6,022 × 1023 phân tử oxygen.
⇒ 0,25 mol khí O2 có 0,25 × 6,022 × 1023 = 1,5055 × 1023 phân tử oxygen.
2. Khối lượng mol
Trả lời:
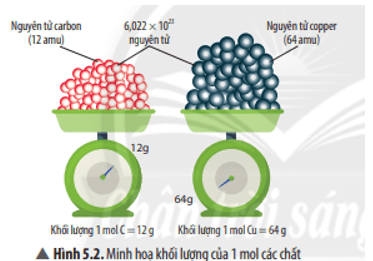
- Khối lượng của 1 mol C là 12 gam.
- Khối lượng của 1 mol Cu là 64 gam.
Câu hỏi thảo luận 3 trang 28 KHTN 8: Nếu các chất có cùng số mol thì có cùng khối lượng không?
Trả lời:
Các chất có cùng số mol chưa chắc đã cùng khối lượng.
Ví dụ:
1 mol Cu có khối lượng 64 gam.
1 mol SO2 có khối lượng 64 gam.
1 mol H2 có khối lượng 2 gam.
Trả lời:
Khối lượng mol nguyên tử hay khối lượng mol phân tử của một chất có cùng trị số với khối lượng nguyên tử hay khối lượng phân tử của chất đó.
Trả lời:
|
Chất |
Khối lượng nguyên tử (amu) |
Khối lượng phân tử (amu) |
Khối lượng (gam/ mol) |
|
Ethanol (C2H5OH) |
H = 1 C = 12 O = 16 |
46 |
46 |
|
Muối ăn (NaCl) |
Na = 23 Cl = 35,5 |
58,5 |
58,5 |
b) Tìm khối lượng mol của hợp chất A, biết rằng 0,5 mol của hợp chất này có khối lượng là 22 gam.
Trả lời:
a) Khối lượng mol phân tử bromine: MBr2=80×2=160(g/mol);
Khối lượng của 0,5 mol phân tử bromine:
mBr2=0,5×160=80(gam).
b) Khối lượng mol của hợp chất A:
3. Thể tích mol chất khí
Trả lời:
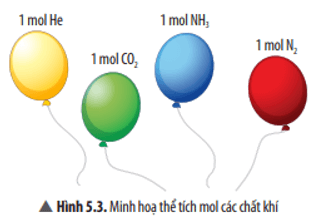
Thể tích của 1 mol các chất khí ở cùng điều kiện về nhiệt độ và áp suất trong Hình 5.3 là bằng nhau.
Trả lời:
Ở nhiệt độ 25 oC và áp suất là 1 bar, 1 mol chất khí bất kì có thể tích bằng 24,79 lít.
Trả lời:
Gọi n là số mol chất khí (mol); V là thể tích của chất khí ở đkc (lít), ta có công thức chuyển đổi sau: V = n × 24,79.
Luyện tập trang 30 KHTN 8: a) Hãy cho biết 0,1 mol CO2 ở đkc có thể tích là bao nhiêu lít.
b) 4,958 lít khí O2 (đkc) có số mol là bao nhiêu?
Trả lời:
a) VCO2=0,1×24,79=2,479 (lit).b) nO2=4,95824,79=0,2 (mol).
Trả lời:
nSO2=6,224,79≈0,25(mol)⇒mSO2=0,25×64=16(gam).
Cứ 0,1 gam SO2 có thể bảo quản được 1 kg trái vải sấy khô.
⇒ 16 gam SO2 có thể bảo quản được 16×10,1=160(kg) trái vải sấy khô.
4. Tỉ khối của chất khí
Câu hỏi thảo luận 8 trang 30 KHTN 8: Bằng cách nào ta có thể biết được khí A nặng hay nhẹ hơn khí B?
Trả lời:
Để biết khí A nặng hay nhẹ hơn khí B bao nhiêu lần, ta so sánh khối lượng của hai thể tích khí bằng nhau ở cùng điều kiện nhiệt độ và áp suất.
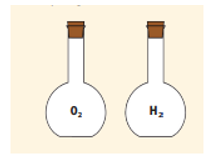
Luyện tập trang 31 KHTN 8: Hãy cho biết khí oxygen nặng hay nhẹ hơn khí hydrogen bao nhiêu lần?
Trả lời:
dO2H2=MO2MH2=322=16
Vậy khí oxygen nặng hơn khí hydrogen 16 lần.
Trả lời:
M1 = 0,0625 × 32 = 2 (g/mol).
M2 = 2 × 32 = 64 (g/mol).
Vận dụng trang 31 KHTN 8: Có 2 quả bóng được bơm đầy 2 khí helium và carbon dioxide như hình bên:
Trả lời:
Khối lượng mol của khí helium là: 4 gam/mol < 29 gam/mol;
Khối lượng mol của khí carbon dioxide là: 44 gam/mol > 29 gam/mol;
Nếu buông tay ra thì quả bóng chứa khí helium bay lên được, vì khí helium nhẹ hơn không khí.
Kiến thức trọng tâm KHTN 8 Bài 5: Mol và tỉ khối của chất khí
I. Mol
Mol là lượng chất có chứa 6,022 × 1023 nguyên tử hay phân tử của chất đó.
Số 6,022 × 1023 gọi là số Avogadro và được kí hiệu là N.
Ví dụ:
1 mol nguyên tử Fe có chứa 6,022 × 1023 nguyên tử Fe.
1 mol phân tử NaCl có chứa 6,022 × 1023 phân tử NaCl.
II. Khối lượng mol
1. Khái niệm
Khối lượng mol (kí hiệu là M) của một chất là khối lượng tính bằng gam của 1 mol chất đó. Đơn vị khối lượng mol là gam/mol (hay gam.mol-1).
Ví dụ:
Khối lượng mol nguyên tử Cu là 64 gam/mol.
Khối lượng mol phân tử nước là 18 gam/mol.
2. Chuyển đổi giữa số mol và khối lượng
Gọi n là số mol chất (mol), M là khối lượng mol của chất (gam/mol) và m là khối lượng chất (gam), ta có công thức chuyển đổi sau:
n=mM⇐ m=n×M⇒M=mn
III. Thể tích mol chất khí
1. Khái niệm
Một mol bất kì khí nào, trong cùng điều kiện nhiệt độ và áp suất đều chiếm những thể tích bằng nhau, người ta gọi đó là thể tích mol chất khí.
Định luật Avogadro: Trong cùng điều kiện nhiệt độ và áp suất, các khí có cùng thể tích sẽ chứa cùng số mol.
Ở điều kiện chuẩn (đkc) áp suất 1 bar, nhiệt độ 25oC thì 1 mol bất kì khí nào cũng đều chiếm thể tích 24,79 lít.
Ví dụ: Thể tích 1 mol khí O2 cũng như 1 mol khí N2 ở điều kiện chuẩn đều là 24,79 lít.
2. Chuyển đổi giữa số mol và thể tích
Gọi n là số mol chất khí (mol), V là thể tích của chất khí ở đkc (lít), ta có công thức chuyển đổi sau:
V=n×24,79⇒n=V24,79
IV. Tỉ khối của chất khí
Tỉ khối của chất khí A đối với khí B là tỉ số giữa khối lượng mol của khí A và khối lượng mol của khí B.
dA/B=MAMB
Trong đó:
dA/B là tỉ khối của khí A đối với khí B.
MA, MB là khối lượng mol của khí A và khí B (gam/mol).
Xem thêm lời giải bài tập Khoa học tự nhiên lớp 8 Chân trời sáng tạo hay, chi tiết khác:
Bài 6: Tính theo phương trình hoá học
Xem thêm các chương trình khác:
- Soạn văn lớp 8 Chân trời sáng tạo (hay nhất)
- Văn mẫu lớp 8 - Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn 8 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn lớp 8 – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 8 - Chân trời sáng tạo
- Giải SBT Ngữ văn 8 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 8 – Chân trời sáng tạo
- Soạn văn 8 Chân trời sáng tạo (ngắn nhất)
- Giải sgk Toán 8 – Chân trời sáng tạo
- Lý thuyết Toán 8 – Chân trời sáng tạo
- Giải sbt Toán 8 – Chân trời sáng tạo
- Giải sgk Tiếng Anh 8 – Friends Plus
- Giải sbt Tiếng Anh 8 - Friends plus
- Trọn bộ Từ vựng Tiếng Anh 8 Friends plus đầy đủ nhất
- Trọn bộ Ngữ pháp Tiếng Anh 8 Friends plus đầy đủ nhất
- Giải sgk Lịch sử 8 – Chân trời sáng tạo
- Lý thuyết Lịch sử 8 - Chân trời sáng tạo
- Giải sbt Lịch sử 8 – Chân trời sáng tạo
- Giải sgk Địa lí 8 – Chân trời sáng tạo
- Lý thuyết Địa lí 8 - Chân trời sáng tạo
- Giải sbt Địa lí 8 – Chân trời sáng tạo
- Giải sgk Giáo dục công dân 8 – Chân trời sáng tạo
- Lý thuyết Giáo dục công dân 8 – Chân trời sáng tạo
- Giải sbt Giáo dục công dân 8 – Chân trời sáng tạo
- Giải sgk Công nghệ 8 – Chân trời sáng tạo
- Lý thuyết Công nghệ 8 - Chân trời sáng tạo
- Giải sbt Công nghệ 8 – Chân trời sáng tạo
- Giải sgk Tin học 8 – Chân trời sáng tạo
- Lý thuyết Tin học 8 - Chân trời sáng tạo
- Giải sbt Tin học 8 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 8 – Chân trời sáng tạo