Giải KHTN 8 Bài 7 (Chân trời sáng tạo): Nồng độ dung dịch
Với lời giải bài tập Khoa học tự nhiên lớp 8 Bài 7: Nồng độ dung dịch sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi và làm bài tập KHTN 8 Bài 7.
Giải KHTN 8 Bài 7: Nồng độ dung dịch
Trả lời:
Đại lượng dùng để đánh giá độ đặc, loãng của dung dịch là nồng độ.
1. Dung dịch
Trả lời:
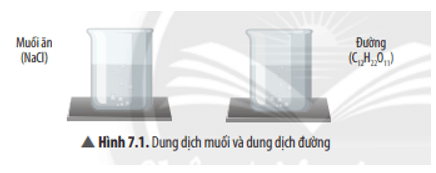
- Trong dung dịch muối: chất tan là muối ăn (NaCl); dung môi là nước.
- Trong dung dịch đường: chất tan là đường (C12H22O11); dung môi là nước.
Câu hỏi thảo luận 2 trang 35 KHTN 8: Tại sao lại gọi nước đường, nước muối là các dung dịch?
Trả lời:
Khi hoà tan đường hay muối (chất rắn) vào nước (chất lỏng) sẽ tạo thành nước đường hay nước muối (hỗn hợp đồng nhất).
Do đó có thể gọi nước đường, nước muối là các dung dịch.
2. Độ tan của một chất trong nước
Câu hỏi thảo luận 3 trang 35 KHTN 8: Độ tan của một chất trong nước phụ thuộc vào những yếu tố nào?
Trả lời:
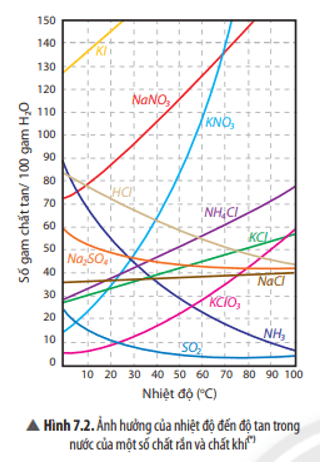
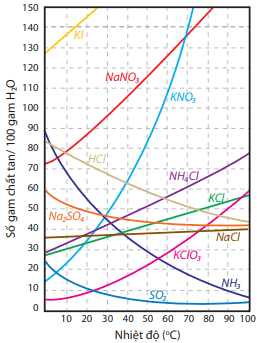
Độ tan của một chất trong nước phụ thuộc vào nhiệt độ. Ngoài ra đối với chất khí, độ tan phụ thuộc vào nhiệt độ và áp suất.
Trả lời:
- Độ tan của chất rắn sẽ tăng khi tăng nhiệt độ (trừ số ít trường hợp như Na2SO4 …)
- Độ tan của chất khí sẽ tăng khi giảm nhiệt độ.
Trả lời:
Áp dụng công thức:
S=mctmdm×100=76,75250×100=30,7 (g/100g nước).
Vận dụng trang 36 KHTN 8: Hãy giải thích tại sao:
b) Trong sản xuất nước ngọt có gas, người ta thường nén khí (carbon dioxide) ở áp suất cao.
Trả lời:
a) Đường hoặc muối ăn tan tốt trong nước nóng, tan kém trong nước lạnh. Do đó khi pha nước chanh đá, người ta thường hoà tan đường hoặc muối ăn vào nước nóng, sau đó mới cho đá lạnh vào.
b) Độ tan của khí carbon dioxide tăng khi ở áp suất cao. Do đó trong sản xuất nước ngọt có gas, người ta thường nén khí (carbon dioxide) ở áp suất cao.
3. Nồng độ dung dịch
Trả lời:
3 dung dịch của cùng một chất nhưng màu sắc của chúng lại khác nhau do nồng độ của chúng khác nhau.
Trả lời:
Công thức tính nồng độ phần trăm của dung dịch:
C%=mctmdd×100(%)
Để tính nồng độ phần trăm của dung dịch ta cần biết những thông tin:
+ Khối lượng chất tan (mct);
+ Khối lượng dung dịch (mdd).
Trả lời:
Khối lượng dung dịch = khối lượng dung môi + khối lượng chất tan
= 129 + 21 = 150 gam.
Nồng độ phần trăm của dung dịch KNO3 thu được là:
C%=mctmdd×100(%)=21150×100(%)=14(%).
Câu hỏi thảo luận 7 trang 37 KHTN 8: Làm thế nào để xác định được nồng độ mol của dung dịch?
Trả lời:
Công thức tính nồng độ mol của dung dịch:
CM=nVdd
Như vậy để tính nồng độ mol của dung dịch cần biết: số mol chất tan và thể tích dung dịch.
Trả lời:
Số mol chất tan: nCuSO4=16160=0,1(mol);
Đổi 200 ml = 0,2 lít.
Nồng độ mol của dung dịch CuSO4 là:
CM=nVdd=0,10,2=0,5(M).
4. Pha chế dung dịch
Trả lời:
Dụng cụ và hoá chất: 1 ống đong có dung tích 150 mL, đũa thuỷ tinh, cân đồng hồ hoặc cân điện tử, muối ăn, nước cất.
Tính toán:
Số mol chất tan: nNaCl = 0,1 × 1 = 0,1 (mol);
Khối lượng của 0,1 mol NaCl: mNaCl = 0,1 × 58,5 = 5,85 (gam).
Cách pha chế:
- Cân lấy 5,85 gam NaCl cho vào ống đong có dung tích 150 mL.
- Rót từ từ nước cất vào ống đong và khuấy nhẹ cho đủ 100 mL dung dịch, ta thu được 100 mL dung dịch NaCl.
Trả lời:
Khối lượng muối có trong 1 000 kg nước biển là:
mNaCl=1000×3,5100=35(kg)
Gọi x (kg) là khối lượng nước ngọt mà bác nông dân phải thêm vào hồ (x > 0).
Khi đó lượng nước trong hồ sau khi đổ nước ngọt là: 1 000 + x (kg).
Theo bài ra ta có phương trình:
351000+x×100=1⇔x=2500.
Vậy bác nông dân phải thêm vào hồ 2 500 kg nước ngọt.
Kiến thức trọng tâm KHTN 8 Bài 7: Nồng độ dung dịch
I. Dung dịch
Dung dịch là hỗn hợp đồng nhất của chất tan và dung môi.
Ví dụ:
Hoà tan đường vào nước được dung dịch nước đường.
Trong đó, đường là chất tan và nước là dung môi.
II. Độ tan của một chất trong nước
Độ tan của một chất trong nước là số gam tối đa chất đó hoà tan trong 100 gam nước để tạo thành dung dịch bão hoà ở một nhiệt độ, áp suất xác định.
Độ tan được tính theo công thức:
S=mctmdm×100
Trong đó:
S là độ tan (đơn vị gam/100 gam nước);
mct là khối lượng chất tan (đơn vị gam);
mdm là khối lượng dung môi (đơn vị gam);
Nói chung, độ tan của chất rắn sẽ tăng khi tăng nhiệt độ (trừ một số ít trường hợp); độ tan của chất khí sẽ tăng khi giảm nhiệt độ và tăng áp suất.
Ảnh hưởng của nhiệt độ đến độ tan trong nước của một số chất rắn và chất khí được thể hiện bằng biểu đồ sau:
III. Nồng độ dung dịch
Có nhiều cách để biểu thị nồng độ dung dịch, hay sử dụng là nồng độ phần trăm và nồng độ mol.
1. Tính nồng độ phần trăm của dung dịch
Nồng độ phần trăm (kí hiệu C%) của một dung dịch là số gam chất tan có trong 100 gam dung dịch.
Công thức tính nồng độ phần trăm của dung dịch:
C%=mctmdd×100(%)
Trong đó:
mct: khối lượng chất tan (đơn vị gam);
mdd: khối lượng dung dịch (đơn vị gam).
Ví dụ:
Hoà tan 21 gam KNO3 vào 129 gam nước thu được dung dịch KNO3. Tính nồng độ phần trăm của dung dịch KNO3 thu được.
Hướng dẫn giải:
Khối lượng dung dịch = khối lượng dung môi + khối lượng chất tan
= 129 + 21 = 150 gam.
Nồng độ phần trăm của dung dịch KNO3 thu được là:
C%=mctmdd×100(%)=21150×100(%)=14(%).
2. Tính nồng độ mol của dung dịch
Nồng độ mol (kí hiệu CM) của dung dịch là số mol chất tan (n) có trong 1 lít dung dịch.
Công thức tính nồng độ mol của dung dịch:
CM=nVdd
Trong đó:
n: số mol chất tan (đơn vị mol);
Vdd: thể tích dung dịch (đơn vị lít, L);
CM: nồng độ mol của dung dịch (đơn vị mol/L hoặc M).
Ví dụ:
Hoà tan 16 gam CuSO4 khan vào nước thu được 200 ml dung dịch CuSO4. Tính nồng độ mol của dung dịch CuSO4.
Hướng dẫn giải:
Số mol chất tan: nCuSO4=16160=0,1(mol);
Đổi 200 ml = 0,2 lít.
Nồng độ mol của dung dịch CuSO4 là:
CM=nVdd=0,10,2=0,5(M).
IV. Pha chế dung dịch
Để pha chế một dung dịch có nồng độ cho trước, ta cần phải biết lượng chất tan (khối lượng hay số mol) cần dùng để hoà tan trong một lượng dung môi.
Ví dụ 1: Pha chế 50 gam dung dịch CaCl2 có nồng độ 10%.
Hướng dẫn:
Dụng cụ và hoá chất: 1 cốc thuỷ tinh, đũa thuỷ tinh, cân đồng hồ hoặc cân điện tử, calcium chloride (CaCl2) khan, nước cất.
Tính toán:
- Tìm khối lượng chất tan:
mCaCl2=10×50100=5(g)
- Tìm khối lượng dung môi (nước):
mdm = mdd – mct = 50 – 5 = 45 (gam).
Cách pha chế:
- Cân lấy 5 gam CaCl2 khan (màu trắng) cho vào cốc có dung tích 100 mL.
- Cân lấy 45 gam (hoặc đong lấy 45 mL) nước cất.
- Rót nước vào cốc và khuấy nhẹ, ta thu được 50 gam dung dịch CaCl2 10%.
Ví dụ 2: Từ muối ăn NaCl, nước cất và các dụng cụ cần thiết. Hãy tính toán và nêu cách pha chế 100 mL dung dịch NaCl có nồng độ 1 M.
Hướng dẫn:
Dụng cụ và hoá chất: 1 ống đong có dung tích 150 mL, đũa thuỷ tinh, cân đồng hồ hoặc cân điện tử, muối ăn, nước cất.
Tính toán:
Số mol chất tan: nNaCl = 0,1 × 1 = 0,1 (mol);
Khối lượng của 0,1 mol NaCl: mNaCl = 0,1 × 58,5 = 5,85 (gam).
Cách pha chế:
- Cân lấy 5,85 gam NaCl cho vào ống đong có dung tích 150 mL.
- Rót từ từ nước cất vào ống đong và khuấy nhẹ cho đủ 100 mL dung dịch, ta thu được 100 mL dung dịch NaCl.
Xem thêm lời giải bài tập Khoa học tự nhiên lớp 8 Chân trời sáng tạo hay, chi tiết khác:
Xem thêm các chương trình khác:
- Soạn văn lớp 8 Chân trời sáng tạo (hay nhất)
- Văn mẫu lớp 8 - Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn 8 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn lớp 8 – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 8 - Chân trời sáng tạo
- Giải SBT Ngữ văn 8 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 8 – Chân trời sáng tạo
- Soạn văn 8 Chân trời sáng tạo (ngắn nhất)
- Giải sgk Toán 8 – Chân trời sáng tạo
- Lý thuyết Toán 8 – Chân trời sáng tạo
- Giải sbt Toán 8 – Chân trời sáng tạo
- Giải sgk Tiếng Anh 8 – Friends Plus
- Giải sbt Tiếng Anh 8 - Friends plus
- Trọn bộ Từ vựng Tiếng Anh 8 Friends plus đầy đủ nhất
- Trọn bộ Ngữ pháp Tiếng Anh 8 Friends plus đầy đủ nhất
- Giải sgk Lịch sử 8 – Chân trời sáng tạo
- Lý thuyết Lịch sử 8 - Chân trời sáng tạo
- Giải sbt Lịch sử 8 – Chân trời sáng tạo
- Giải sgk Địa lí 8 – Chân trời sáng tạo
- Lý thuyết Địa lí 8 - Chân trời sáng tạo
- Giải sbt Địa lí 8 – Chân trời sáng tạo
- Giải sgk Giáo dục công dân 8 – Chân trời sáng tạo
- Lý thuyết Giáo dục công dân 8 – Chân trời sáng tạo
- Giải sbt Giáo dục công dân 8 – Chân trời sáng tạo
- Giải sgk Công nghệ 8 – Chân trời sáng tạo
- Lý thuyết Công nghệ 8 - Chân trời sáng tạo
- Giải sbt Công nghệ 8 – Chân trời sáng tạo
- Giải sgk Tin học 8 – Chân trời sáng tạo
- Lý thuyết Tin học 8 - Chân trời sáng tạo
- Giải sbt Tin học 8 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 8 – Chân trời sáng tạo