Giải KHTN 8 (Chân trời sáng tạo): Ôn tập chương 2
Với lời giải bài tập Khoa học tự nhiên lớp 8 Ôn tập chương 2 sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi và làm bài tập KHTN 8.
Giải KHTN 8 Ôn tập chương 2
Bài 1 trang 75 KHTN 8: Mô tả các hiện tượng xảy ra khi:
a) Cho một mẩu giấy quỳ tím vào dung dịch NaOH, sau đó thêm từ từ dung dịch HCl vào cho đến dư.
Trả lời:
a) Cho một mẩu giấy quỳ tím vào dung dịch NaOH quỳ tím có màu xanh, sau đó thêm từ từ dung dịch HCl vào cho đến dư quỳ tím chuyển sang màu đỏ.
b) Dung dịch chuyển từ không màu sang màu hồng.
Bài 2 trang 75 KHTN 8: Chỉ dùng dung dịch NaOH, hãy phân biệt mỗi dung dịch trong các dãy sau:
a) Dung dịch NaCl, dung dịch CuSO4 và dung dịch MgCl2.
b) Dung dịch Na2SO4, dung dịch FeCl2, dung dịch CuSO4 và dung dịch MgSO4.
Trả lời:
a) Trích mẫu thử.
Cho lần lượt từng mẫu thử tác dụng với dung dịch NaOH.
+ Không có hiện tượng xuất hiện → mẫu thử là NaCl.
+ Xuất hiện kết tủa trắng → mẫu thử là MgCl2:
MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl
+ Xuất hiện kết tủa xanh → mẫu thử là CuSO4:
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4.
b) Trích mẫu thử.
Cho lần lượt từng mẫu thử tác dụng với dung dịch NaOH.
+ Không có hiện tượng xuất hiện → mẫu thử là Na2SO4.
+ Xuất hiện kết tủa trắng → mẫu thử là MgSO4.
MgSO4 + 2NaOH → Mg(OH)2↓ + Na2SO4.
+ Xuất hiện kết tủa xanh → mẫu thử là CuSO4:
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4.
+ Xuất hiện kết tủa trắng xanh, sau một thời gian kết tủa chuyển sang nâu đỏ → FeCl2:
FeCl2 + 2NaOH → Fe(OH)2↓ + 2NaCl
4Fe(OH)2↓ + O2 + 2H2O → 4Fe(OH)3↓
a) Oxide acid phản ứng với dung dịch base.
b) Oxide base phản ứng với dung dịch acid.
c) Base phản ứng với dung dịch acid.
Viết phương trình hoá học của các phản ứng trên.
Trả lời:
Muối được điều chế bằng phương pháp:
a) Oxide acid phản ứng với dung dịch base là: BaCO3.
Ba(OH)2 + CO2 → BaCO3↓ + H2O.
b) Oxide base phản ứng với dung dịch acid: CuCl2, MgSO4.
CuO + 2HCl → CuCl2 + H2O
MgO + H2SO4 → MgSO4 + H2O
c) Base phản ứng với dung dịch acid: CuCl2, MgSO4.
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
Mg(OH)2 + H2SO4 → MgSO4 + 2H2O
a) Viết phương trình hoá học của phản ứng tạo sodium sulfite từ sulfur dioxide.
Trả lời:
a) Phương trình hoá học: SO2 + 2NaOH → Na2SO3 + H2O
Tỉ lệ phản ứng: 1 2 1 1
b) Theo bài ra: nNa2SO3=1,26126=0,01(mol)
Theo phương trình hoá học:
nSO2=nNa2SO3=0,01(mol)⇒VSO2=0,01×24,79=0,2479(L).
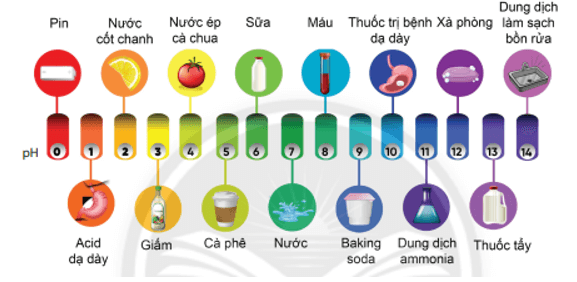
Bài 5 trang 76 KHTN 8: Hình vẽ sau đây giới thiệu các giá trị pH của một số sản phẩm hàng ngày:
Hãy quan sát và trả lời các câu hỏi sau:
a) Giữa sữa và cam, loại nào có tính acid mạnh hơn?
b) Giữa xà phòng và dung dịch làm sạch bồn rửa, loại nào có tính base mạnh hơn?
c) Sản phẩm nào trung tính (không có tính acid hay tính base)?
d) Sản phẩm nào có tính acid mạnh nhất được hiển thị trong thang pH ở trên?
e) Sản phẩm nào có tính base mạnh nhất được hiển thị trong thang pH ở trên?
Trả lời:
a) Giữa sữa và cam, loại có tính acid mạnh hơn là cam.
b) Giữa xà phòng và dung dịch làm sạch bồn rửa, loại có tính base mạnh hơn là dung dịch làm sạch bồn rửa.
c) Sản phẩm trung tính (không có tính acid hay tính base) là nước.
d) Sản phẩm có tính acid mạnh nhất được hiển thị trong thang pH ở trên là pin.
e) Sản phẩm có tính base mạnh nhất được hiển thị trong thang pH ở trên là dung dịch làm sạch bồn rửa.
Trả lời:
Sau một thời gian lớp sáng bóng bị mờ đi do lớp nhôm phía ngoài vật dụng phản ứng với oxygen có trong không khí.
4Al + 3O2 → 2Al2O3
Trả lời:
Tro bếp có chứa potassium (kali, K). Đây là nguyên tố đa lượng.
Trả lời:
Giả sử có 100 gam phân kali.
⇒ Khối lượng potassium chloride có trong 100 gam phân này là 85 gam.
⇒ nKCl=8574,5=170149(mol)
Bảo toàn nguyên tố K có:
nK2O=12×nKCl=12×170149=85149(mol).
Hàm lượng dinh dưỡng của loại phân kali này là:
85149×94100×100=53,62%.
a) Viết phương trình hoá học của phản ứng tạo magnesium chloride từ magnesium oxide.
Trả lời:
a) Phương trình hoá học: MgO + 2HCl → MgCl2 + H2O
Tỉ lệ phản ứng: 1 2 1 1
b) nMgO=840=0,2(mol)
Theo phương trình hoá học ta có:
nMgCl2=nMgO=0,2(mol)⇒mMgCl2=0,2.95=19(gam).nHCl=2.nMgO=0,4(mol)⇒VHCl=0,42=0,2(L).
Xem thêm lời giải bài tập Khoa học tự nhiên lớp 8 Chân trời sáng tạo hay, chi tiết khác:
Bài 17: Áp suất trong chất lỏng
Xem thêm các chương trình khác:
- Soạn văn lớp 8 Chân trời sáng tạo (hay nhất)
- Văn mẫu lớp 8 - Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn 8 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn lớp 8 – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 8 - Chân trời sáng tạo
- Giải SBT Ngữ văn 8 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 8 – Chân trời sáng tạo
- Soạn văn 8 Chân trời sáng tạo (ngắn nhất)
- Giải sgk Toán 8 – Chân trời sáng tạo
- Lý thuyết Toán 8 – Chân trời sáng tạo
- Giải sbt Toán 8 – Chân trời sáng tạo
- Giải sgk Tiếng Anh 8 – Friends Plus
- Giải sbt Tiếng Anh 8 - Friends plus
- Trọn bộ Từ vựng Tiếng Anh 8 Friends plus đầy đủ nhất
- Trọn bộ Ngữ pháp Tiếng Anh 8 Friends plus đầy đủ nhất
- Giải sgk Lịch sử 8 – Chân trời sáng tạo
- Lý thuyết Lịch sử 8 - Chân trời sáng tạo
- Giải sbt Lịch sử 8 – Chân trời sáng tạo
- Giải sgk Địa lí 8 – Chân trời sáng tạo
- Lý thuyết Địa lí 8 - Chân trời sáng tạo
- Giải sbt Địa lí 8 – Chân trời sáng tạo
- Giải sgk Giáo dục công dân 8 – Chân trời sáng tạo
- Lý thuyết Giáo dục công dân 8 – Chân trời sáng tạo
- Giải sbt Giáo dục công dân 8 – Chân trời sáng tạo
- Giải sgk Công nghệ 8 – Chân trời sáng tạo
- Lý thuyết Công nghệ 8 - Chân trời sáng tạo
- Giải sbt Công nghệ 8 – Chân trời sáng tạo
- Giải sgk Tin học 8 – Chân trời sáng tạo
- Lý thuyết Tin học 8 - Chân trời sáng tạo
- Giải sbt Tin học 8 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 8 – Chân trời sáng tạo