Đề cương ôn tập Hóa học 10 Học kì 2 (Chân trời sáng tạo 2025)
Vietjack.me biên soạn và giới thiệu Đề cương ôn tập Hóa học 10 Học kì 2 sách Chân trời sáng tạo giúp bạn ôn luyện và đạt kết quả cao trong bài thi Hóa học 10 Học kì 2.
Đề cương ôn tập Hóa học 10 Học kì 2 (Chân trời sáng tạo 2025)
A. KIẾN THỨC TRỌNG TÂM
CHỦ ĐỀ 4: PHẢN ỨNG OXI HÓA - KHỬ VÀ ENTHALPY
1. Phản ứng oxi hóa - khử
- Số oxi hóa của một nguyên tử trong phân tử là điện tích của nguyên tử nguyên tố đó nếu giả định cặp electron chung thuộc hẳn về nguyên tử của nguyên tố có độ âm điện lớn hơn.
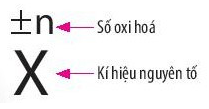
- Phản ứng oxi hoá - khử là phản ứng hoá học, trong đó có sự chuyển dịch electron giữa các chất phản ứng hay có sự thay đổi số oxi hoá của một số nguyên tử trong phân tử.
- Quá trình oxi hoá (sự oxi hoá) là quá trình nhường electron. Quá trình khử (sự khử) là quá trình nhận electron.
- Chất khử (chất bị oxi hóa) là chất nhường electron. Chất oxi hóa (chất bị khử) là chất nhận electron.
- Nguyên tắc của phương pháp: Tổng số electron chất khử nhường = Tổng số electron chất oxi hoá nhận.
+ Bước 1: Xác định số oxi hóa của các nguyên tố để tìm chất oxi hoá và chất khử.
+ Bước 2: Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình.
+ Bước 3: Tìm hệ số thích hợp cho chất oxh và chất khử sao cho tổng số electron cho bằng tổng số electron nhận.
+ Bước 4: Đặt hệ số của các chất oxh và khử vào sơ đồ phản ứng, từ đó tính ra hệ số các chất khác. Kiểm tra cân bằng số nguyên tử của các nguyên tố và cân bằng điện tích hai vế để hoàn thành PTHH
- Ý nghĩa của phản ứng oxi hóa - khử
+ Một số phản ứng oxi hoá - khử quan trọng gắn liền với cuộc sống như sự cháy của than, củi; sự cháy của xăng dầu trong các động cơ đốt trong các quá trình điện phân; các phản ứng xảy ra trong pin, ắc quy, ...
+ Một số phản ứng oxi hoá - khử là cơ sở của quá trình sản xuất trong các ngành công nghiệp nặng, sản xuất các hoá chất cơ bản; sản xuất phân bón, thuốc bảo vệ thực vật; dược phẩm; ...
2. Enthalpy và biến thiên Enthalpy của phản ứng hóa học
- Phản ứng tỏa nhiệt, phản ứng thu nhiệt:
+ Phản ứng tỏa nhiệt là phản ứng hoá học trong đó có sự giải phóng nhiệt năng ra môi trường.
+ Phản ứng thu nhiệt là phản ứng hoá học trong đó có sự hấp thụ nhiệt năng từ môi trường.
- Biến thiên Enthalpy chuẩn của phản ứng
+ Biến thiên enthalpy chuẩn (hay nhiệt phản ứng chuẩn) của một phản ứng hoá học, được kí hiệu là ![]() là nhiệt kèm theo phản ứng đó trong điều kiện chuẩn.
là nhiệt kèm theo phản ứng đó trong điều kiện chuẩn.
+ Điều kiện chuẩn: áp suất 1 bar (đối với chất khí), nồng độ 1 mol/L (đối với chất tan trong dung dịch) và thường chọn nhiệt độ 25°C (hay 298 K).
- Enthalpy tạo thành (nhiệt tạo thành): Enthalpy tạo thành của một chất là nhiệt kèm theo phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất.
- Ý nghĩa của dấu và giá trị ![]()
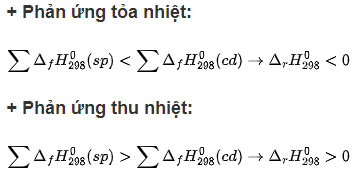
+ Thường các phản ứng có ![]() < 0 thì xảy ra thuận lợi.
< 0 thì xảy ra thuận lợi.
- Tính biến thiên Enthalpy của phản ứng dựa vào năng lượng liên kết ![]()
- Phản ứng hóa học xảy ra khi có sự phá vỡ các liên kết hoá học của chất đầu (cđ) và hình thành các liên kết hoá học của sản phẩm (sp). Sự phá vỡ các liên kết cần cung cấp năng lượng, sự hình thành các liên kết lại giải phóng năng lượng.
aA (g) + bB (g) → mM (g) + nN (g)
![]() = a x E b (A) + b x E b (B) – m x E b (M) - n x E b (N)
= a x E b (A) + b x E b (B) – m x E b (M) - n x E b (N)
=> Tổng quát: ![]()
Với ![]() : tổng năng lượng liên kết trong phân tử chất đầu và sản phẩm của phản ứng.
: tổng năng lượng liên kết trong phân tử chất đầu và sản phẩm của phản ứng.
Chú ý: Tính biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết được áp dụng cho phản ứng trong đó các chất đều có liên kết cộng hoá trị ở thể khí khi biết giá trị năng lượng liên kết của tất cả các chất trong phản ứng.
- Tính biến thiên Enthalpy của phản ứng dựa vào Enthalpy
aA + bB → MM + nN
![]()
![]()
=> Tổng quát: ![]()
Với ![]() tổng enthalpy tạo thành ở điều kiện chuẩn tương ứng của sản phẩm, chất đầu của phản ứng.
tổng enthalpy tạo thành ở điều kiện chuẩn tương ứng của sản phẩm, chất đầu của phản ứng.
B. ÔN TẬP TỰ LUẬN
Bài tập 1:
a, Trong phản ứng: Cu + 2H2SO4(đặc, nóng) → CuSO4 + SO2 + 2H2O, axit sunfuric đóng vai trò gì?
b, Trong phản ứng: CaCO3 → CaO + CO2 , nguyên tố cacbon đóng vai trò gì?
Lời giải:
a, S+6 → S+4 ⇒ H2SO4 đóng vai trò là chất oxi hóa
Mặt khác SO42- đóng vai trò môi trường để tao muối CuSO4
b, C+4 → C+4Cacbon không bị oxi hóa, cũng không bị khử.
Bài tập 2:
a, Tìm số oxi hóa của S trong phân tử H2SO4?
b, Tìm số oxi hóa của Mn trong ion MnO4-?
Lời giải:
a, Gọi số oxi hóa của S trong H2SO4 là x, ta có :
2.(+1) + 1.x + 4.(–2) = 0 → x = +6
Vậy số oxi hóa của S là +6.
a, Gọi số oxi hóa của Mn là x, ta có :
1.x + 4.( –2) = –1 → x = +7
Vậy số oxi hóa của Mn là +7.
Bài tập 5: Hòa tan 15 gam hỗn hợp X gồm hai kim loại Mg và Al vào dung dịch Y gồm HNO3 và H2SO4 đặc thu được 0,1 mol mỗi khí SO2, NO, NO2, N2O. Tính phần trăm khối lượng của Al và Mg trong X
Lời giải:
Ta có 24 nMg + 27 nAl =15 (1)
- Xét quá trình oxi hóa
Mg → Mg2++ 2e
Al → Al3++3e
⇒ tổng số mol e nhường = 2nMg + 3 nAl
- Xét quá trình khử
2N+5 +2.4e → 2 N+1
S+6 + 2e → S+4
⇒ tổng số mol e nhận = 2.0,4 + 0,2 = 1,4 mol
Theo định luật bảo toàn e ta có:
2nMg + 3 nAl = 1,4 (2)
Giải hệ (1) và (2) ta được nMg = 0,4 mol, nAl =0,2 mol
⇒% Al = 27.0,2/15 = 36%
⇒%Mg = 64%
Bài tập 6: Cho 0,5 g bột iron vào bình đựng 25 mL dung dịch CuSO4 0,2M ở 32°C. Khuấy đều dung dịch, quan sát nhiệt kế thấy nhiệt độ lên cao nhất là 39°C. Tính nhiệt của phản ứng. (Giả thiết nhiệt lượng của phản ứng toả ra được dung dịch hấp thụ hết, nhiệt dung của dung dịch loãng bằng nhiệt dung của nước (4,2 J/g.K))
Lời giải:
- Nhiệt lượng tỏa ra là:![]()
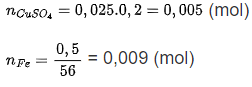
- Phương trình phản ứng: Fe + CuSO4 -> FeSO4 + Cu
-> Phản ứng tính theo CuSO4
![]()
Xem thêm các chương trình khác:
- TOP 100 Đề thi Toán 10 (cả năm) (Kết nối tri thức) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Tiếng Anh 10 (cả năm) Global Success năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Ngữ Văn 10 (cả năm) (Kết nối tri thức) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Hóa học 10 (cả năm) (Kết nối tri thức) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Vật lí 10 (cả năm) (Kết nối tri thức) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Sinh học 10 (cả năm) (Kết nối tri thức) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Lịch sử 10 (cả năm) (Kết nối tri thức) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Địa lí 10 (cả năm) (Kết nối tri thức) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Công nghệ 10 (cả năm) (Kết nối tri thức) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Kinh tế pháp luật 10 (cả năm) (Kết nối tri thức) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Tin học 10 (cả năm) (Kết nối tri thức) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Toán 10 (cả năm) (Cánh diều) 2024 - 2025 có đáp án
- TOP 100 Đề thi Tiếng Anh 10 (cả năm) Explore new worlds năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Ngữ Văn 10 (cả năm) (Cánh diều) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Hóa học 10 (cả năm) (Cánh diều) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Vật lí 10 (cả năm) (Cánh diều) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Sinh học 10 (cả năm) (Cánh Diều) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Lịch sử 10 (cả năm) (Cánh diều) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Địa lí 10 (cả năm) (Cánh Diều) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Công nghệ 10 (Cả năm) (Cánh Diều) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Kinh tế pháp luật 10 (cả năm) (Cánh Diều) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Tin học 10 (cả năm) (Cánh Diều) 2024 - 2025 có đáp án
- TOP 100 Đề thi Tiếng Anh 10 (cả năm) iLearn Smart World năm 2024 - 2025 có đáp án
