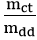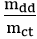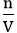Công thức tính nồng độ mol (CM) chi tiết
Với Công thức tính nồng độ mol (CM) chi tiết nhất giúp học sinh dễ dàng nhớ toàn bộ các Công thức tính nồng độ mol chi tiết | Công thức tính CM từ đó biết cách làm bài tập Hóa học 9. Mời các bạn đón xem:
Công thức tính nồng độ mol (CM) chi tiết
I. Nồng độ mol là gì?
Nồng độ mol là đại lượng cho biết mối liên hệ giữa số mol của một chất tan và thể tích của dung dịch.
II. Công thức tính nồng độ mol
1. Công thức về nồng độ mol khi biết số mol và thể tích
Trong đó:
n: số mol chất tan (đơn vị: mol)
V: thể tích dung dịch (đơn vị: lít)
2. Công thức về nồng độ mol khi biết nồng độ phần trăm và khối lượng riêng
CM =
Trong đó:
D: khối lượng riêng (đơn vị: g/ml)
C%: nồng độ phần trăm (đơn vị: C%)
M: khối lượng mol (đơn vị: g/mol)
3. Cách tính nồng độ mol
Tính số mol chất hóa học (n):
Số mol chất hóa học có thể được tính dựa trên khối lượng hoặc thể tích, tùy theo thông tin bạn có.
Nếu bạn có khối lượng chất hóa học (m) trong dung dịch và biết khối lượng mol của nó (M), bạn có thể sử dụng công thức: n = .
Nếu bạn có thông tin về thể tích khí (V) ở điều kiện tiêu chuẩn (22,4 lít/mol), bạn có thể tính số mol bằng cách sử dụng công thức: n = (đối với các chất khí).
Tính nồng độ mol (M):
Sau khi bạn đã tính được số mol (n), chỉ cần chia số mol đó cho thể tích dung dịch (V) để tính nồng độ mol.
Kết quả sẽ có đơn vị mol/lít (M).
Ví dụ: Nếu bạn có một dung dịch NaOH với khối lượng 40 gram và bạn biết khối lượng mol của NaOH là 40 g/mol. Để tính nồng độ mol của dung dịch NaOH, bạn sẽ thực hiện các bước sau:
Tính số mol NaOH: n = = = 1 mol
Tính nồng độ mol của dung dịch NaOH: M =
4. Một số cách tính khác
|
Điều kiện |
Công thức |
Chú thích |
Đơn vị tính |
|
Khi có nồng độ mol/lít |
n = CM.V |
- n: số mol chất |
mol |
|
- CM: nồng độ mol |
Mol/lit |
||
|
- V: thể tích dung dịch |
lit |
||
|
Khi biết số nguyên tử hay phân tử |
n = A/N |
- A: số nguyên tử hay phân tử |
Nguyên tử hoặc phân tử |
|
- Số Avogadro (số đơn vị trong bất cứ một mol chất nào và có giá trị bằng 6.1023) |
|
||
|
Tính số mol khí tại điều kiện thường |
n = P.V/R.T |
- P: Áp suất |
1 atm = 760mmHg |
|
- V: thể tích khí |
Lít |
||
|
- R: hằng số |
0,082 (hoặc 62400) |
||
|
- T: nhiệt độ tính theo độ Kelvin (K) |
K = 273 + độ C |
Phương pháp giải bài tập:
- Bước 1: Tính số mol chất tan theo đề bài cho
- Bước 2: Tính thể tích dung dịch (nếu bài cho dữ kiện trộn 2 dung dịch)
Chú ý đổi đơn vị đo (lít)
- Bước 3: Tính nồng độ mol dung dịch theo công thức: CM = n/V
III. Bài tập có lời giải
Câu 1: Tính nồng độ mol của dung dịch có chứa 0,75 mol Natri clorua (NaCl) trong 4,2 lít dung dịch?
Hướng dẫn:
Áp dụng công thức:
Nồng độ mol của NaCl là:
Câu 2: Tính nồng độ mol của dung dịch KOH 12%, biết khối lượng riêng của dung dịch là 1,1 g/ml?
Hướng dẫn:
Áp dụng công thức:
Nồng độ mol của KOH là:
Câu 3: Để tính nồng độ mol của dung dịch NaCl người ta làm thế nào?
A. Tính số gam NaCl có trong 100 gam dung dịch.
B. Tính số gam NaCl có trong 1 lít dung dịch.
C. Tính số gam NaCl có trong 1000 gam dung dịch.
D. Tính số mol NaCl có trong 1 lít dung dịch.
Lời giải:
Đáp án D
Vì nồng độ mol của dung dịch cho biết số mol chất tan có trong một lít dung dịch
Câu 4: Công thức tính nồng độ mol dung dịch là:
A. CM =
B. CM =
C. CM =
D. CM = 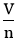
Lời giải:
Đáp án C
Công thức tính nồng độ mol của dung dịch: CM =
Câu 5: Trong 200 ml dung dịch có hoà tan 16 gam KOH. Tính nồng độ mol của dung dịch.
A. 1,2M.
B. 1,2%.
C. 2M.
D. 2%.
Lời giải:
Đáp án C
Đổi 200 ml = 0,2 lít
NKOH = 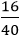
Nồng độ mol của dung dịch KOH là:
Áp dụng công thức: CM = 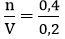
Câu 6: Hòa tan 10,6 gam Na2CO3 vào 456 ml nước thu được dung dịch A. Nồng độ mol của dung dịch A là:
A. 0,32M
B. 0,129M
C. 0,2M
D. 0,219M
Lời giải:
Đáp án D
Đổi 456 ml = 0,456 lít
nNa2CO3 = 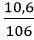
Nồng độ mol của dung dịch Na2CO3 là:
Áp dụng công thức: CM = 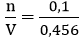
Câu 7: Trộn 2 lít dung dịch đường 0,5M với 3 lít dung dịch đường 1M. Tính nồng độ mol của dung dịch đường sau khi trộn?
A. 0,7M
B. 0,75M
C. 0,8M
D. 0,9M
Lời giải:
Đáp án C
Số mol đường có trong dung dịch sau khi trộn là: n = 0,5.2+1.3 = 4 mol
Thể tích của dung dịch sau khi trộn là: V = 2+3 = 5 lít
Nồng độ mol của dung dịch đường sau khi trộn là:
Áp dụng công thức: CM = 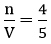
Câu 8: Hoà tan 5,6 gam KOH vào nước, thu được 250ml dung dịch. Nồng độ mol của dung dịch KOH là:
A. 0,2M.
B. 0,3M.
C. 0,4M.
D. 0,5M.
Lời giải:
Đáp án C
Đổi 250 ml = 0,25 lít
nKOH = 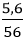
Nồng độ mol của dung dịch KOH là:
Áp dụng công thức: CM = 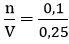
Câu 9: Trong 800 ml của một dung dịch có chứa 7,3 g HCl. Hãy tính nồng độ mol của dung dịch này?
A. 0,4M.
B. 0,3M.
C. 0,25M.
D. 0,5M.
Lời giải:
Đáp án C
Đổi 800 ml = 0,8 lít
nHCl = 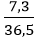
Nồng độ mol của dung dịch HCl là:
Áp dụng công thức: CM = 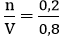
Câu 10: Thêm 11,7g NaCl vào 2 lít dung dịch NaCl 0,5M sẽ được dung dịch có nồng độ gần bằng:
A. 1,5M
B. 1,2M
C. 0,6M
D. 0,1M
Lời giải:
Đáp án C
nNaCl thêm vào = 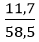
nNaCl ban đầu = 2. 0,5 = 1 mol
Tổng số mol NaCl = 0,2+ 1 = 1,2 mol
Nồng độ dung dịch sau khi thêm là: CM = 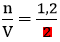
Câu 11: Lấy 32 gam CuSO4 khan cho vào cốc thủy tinh, sau đó đổ nước từ từ vào cốc cho tới vạch 400ml. Khuấy nhẹ dung dịch để chất rắn tan hết. Dung dịch thu được có nồng độ mol là:
A. 1,0%
B. 1,0M
C. 0,5M
D. 0,8M
Lời giải:
Đáp án C
Đổi 400ml = 0,4 lít
nCuSO4 = 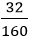
Nồng độ mol của dung dịch CuSO4 là:
Áp dụng công thức: CM = 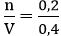
Câu 12: Trong 300 ml của một dung dịch có chứa 20,52 gam Ba(OH)2. Hãy tính nồng độ mol của dung dịch này?
A. 0,4M.
B. 0,3M.
C. 0,25M.
D. 0,5M.
Lời giải:
Đáp án A
Đổi 300 ml = 0,3 lít
nBa(OH)2 = 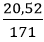
Nồng độ mol của dung dịch Ba(OH)2 là:
Áp dụng công thức: CM = 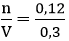
Xem thêm các dạng bài tập Hóa lớp 9 có đáp án và lời giải chi tiết khác:
Công thức tính khối lượng chất tan chi tiết | Công thức tính mct
Công thức tính khối lượng dung dịch chi tiết | Công thức tính mdd
Công thức tính thể tích dung dịch chi tiết | Công thức tính Vdd
Công thức tính thành phần phần trăm về khối lượng các chất trong hỗn hợp
Công thức tính thành phần phần trăm về thể tích các chất trong hỗn hợp
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 9 (sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 9 (hay nhất) | Để học tốt Ngữ văn 9 (sách mới)
- Soạn văn 9 (ngắn nhất)
- Văn mẫu 9 (sách mới) | Để học tốt Ngữ văn 9 Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Tác giả - tác phẩm Ngữ văn 9 (sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Toán 9 (sách mới) | Giải bài tập Toán 9 Tập 1, Tập 2
- Giải sbt Toán 9
- Lý thuyết Toán 9
- Các dạng bài tập Toán lớp 9
- Giáo án Toán lớp 9 mới nhất
- Bài tập Toán lớp 9 mới nhất
- Chuyên đề Toán lớp 9 mới nhất
- Giải sgk Tiếng Anh 9 (thí điểm)
- Giải sgk Tiếng Anh 9 (sách mới) | Để học tốt Tiếng Anh 9
- Giải sbt Tiếng Anh 9
- Giải sbt Tiếng Anh 9 (thí điểm)
- Giải sgk Sinh học 9 (sách mới) | Giải bài tập Sinh học 9
- Giải vở bài tập Sinh học 9
- Lý thuyết Sinh học 9
- Giải sbt Sinh học 9
- Giải sgk Vật Lí 9 (sách mới) | Giải bài tập Vật lí 9
- Giải sbt Vật Lí 9
- Lý thuyết Vật Lí 9
- Các dạng bài tập Vật lí lớp 9
- Giải vở bài tập Vật lí 9
- Giải sgk Địa Lí 9 (sách mới) | Giải bài tập Địa lí 9
- Lý thuyết Địa Lí 9
- Giải Tập bản đồ Địa Lí 9
- Giải sgk Tin học 9 (sách mới) | Giải bài tập Tin học 9
- Lý thuyết Tin học 9
- Lý thuyết Giáo dục công dân 9
- Giải vở bài tập Lịch sử 9
- Giải Tập bản đồ Lịch sử 9
- Lý thuyết Lịch sử 9
- Lý thuyết Công nghệ 9