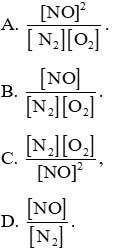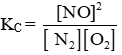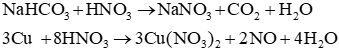Sách bài tập Hóa 11 Bài 6 (Kết nối tri thức): Một số hợp chất của nitrogen với oxygen
Với giải sách bài tập Hóa 11 Bài 6: Một số hợp chất của nitrogen với oxygen sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hóa 11 Bài 6.
Giải SBT Hóa 11 Bài 6: Một số hợp chất của nitrogen với oxygen
B. NOx nhiệt.
C. NOx nhiên liệu.
D. NOx tự nhiên.
Lời giải:
Đáp án đúng là: B
Oxide của nitrogen được tạo thành ở nhiệt độ rất cao, khi nitrogen có trong không khí bị oxi hoá được gọi là NOx nhiệt.
B. NOx tự nhiên.
C. NOx tức thời.
D. NOx nhiệt.
Lời giải:
Đáp án đúng là: A
Oxide của nitrogen được tạo thành khi nguyên tố nitrogen trong nhiên liệu hoặc sinh khối kết hợp với oxygen dư thừa trong không khí được gọi là NOx nhiên liệu.
B. NOx tức thời.
C. NOx tự nhiên.
D. NOx nhiên liệu.
Lời giải:
Đáp án đúng là: B
Oxide của nitrogen được tạo thành khi nitrogen trong không khí tác dụng với các gốc tự do được gọi là NOx tức thời.
B. NOx tức thời.
C. NOx tự nhiên.
D. NOx nhiệt.
Lời giải:
Đáp án đúng là: C
Nitrogen monoxide được tạo thành khi mưa dông kèm theo sấm sét do phản ứng giữa nitrogen và oxygen trong không khí được gọi là NOx tự nhiên.
B. N2, NH3.
C. SO2, NOx.
D. S, H2S.
Lời giải:
Đáp án đúng là: C
Hai tác nhân chính gây mưa acid là SO2, NOx.
Bài 6.6 trang 23 SBT Hóa học 11: Số oxi hoá thấp nhất của nitrogen là
D. +4.
Lời giải:
Đáp án đúng là: A
Số oxi hoá thấp nhất của nitrogen là -3.
Bài 6.7 trang 23 SBT Hóa học 11: Phân tử nào sau đây có chứa một liên kết cho - nhận?
B. N2
C. HNO3.
D. H2.
Lời giải:
Đáp án đúng là: C
Phân tử có chứa một liên kết cho - nhận là phân tử HNO3.
A. HCl.
B. HNO3.
C. HBr.
D. H3PO4.
Lời giải:
Đáp án đúng là: B
HNO3 có tính oxi hoá mạnh.
Bài 6.9 trang 23 SBT Hóa học 11: Kim loại nào sau đây không tác đụng với nitric acid?
B. Cu.
C. Ag.
D. Au.
Lời giải:
Đáp án đúng là: D
Au là kim loại khá trơ, không tan trong acid, kể cả các acid có tính oxi hóa mạnh như HNO3, H2SO4 đặc.
B. Calcium, magnesium.
C. Nitrate, phosphate.
D. Chloride, sulfate.
Lời giải:
Đáp án đúng là: C
Sự dư thừa dinh dưỡng chủ yếu do hàm lượng các ion nitrate, phosphate vượt quá mức cho phép sẽ gây nên hiện tượng phú dưỡng.
B. 2.
C. 3.
D. 4.
Lời giải:
Đáp án đúng là: B
Các nhận định đúng về nitric acid là: (1) có tính acid mạnh và (3) có tính oxi hoá mạnh.
Bài 6.12 trang 23 SBT Hóa học 11: Phát biểu nào sau đây không đúng?
A. NH3 và HCl đều dễ tan trong nước.
B. HNO3 và HCl đều là acid mạnh trong nước.
C. N2 và Cl2 đều có tính oxi hoá mạnh ở điều kiện thường.
D. KNO3 và KClO3 đều bị phân huỷ bởi nhiệt.
Lời giải:
Đáp án đúng là: C
Chỉ có Cl2 có tính oxi hóa mạnh, còn N2 là khí kém hoạt động và khá trơ ở nhiệt độ thường.
Bài 6.13 trang 23 SBT Hóa học 11: Phát biểu nào sau đây đúng?
A. N2 và P đều tác dụng với oxygen ở nhiệt độ cao.
B. N2 và P đều là chất khí ở điều kiện thường.
C. HNO3 và H3PO4 đều có tính oxi hoá mạnh.
D. HNO3 và H3PO4 đều là acid mạnh.
Lời giải:
Đáp án đúng là: A
Phương trình hóa học:
Bài 6.14 trang 24 SBT Hóa học 11: Xét phản ứng trong quá trình tạo ra NOx nhiệt:
A. 180,6 kJ / mol.
B. -180,6 kJ / mol.
C. -90,3 kJ / mol.
D. 90,3 kJ / mol.
Lời giải:
Đáp án đúng là: D
Bài 6.15 trang 24 SBT Hóa học 11: Xét cân bằng tạo ra nitrogen(I) oxide ở nhiệt độ 2000oC:
Ở trạng thái cân bằng, biểu thức nào sau đây có giá trị bằng KC ?
Lời giải:
Đáp án đúng là: A
Tại trạng thái cân bằng,
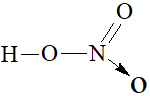
Bài 6.16 trang 24 SBT Hóa học 11: Cho các nhận định sau về cấu tạo phân tử nitric acid:
(a) Liên kết O-H phân cực về oxygen.
(b) Nguyên tử N có số oxi hoá là +5.
(c) Nguyên tử N có hoá trị bằng 4.
(d) Liên kết cho - nhận N → O kém bền.
Số nhận định đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Lời giải:
Đáp án đúng là: D
Tất cả những nhận định trên đều là nhận định đúng và là đặc điểm cấu tạo của phân tử HNO3.
B. NO2, O2, H2O.
C. N2, O2, H2O.
D. N2, H2O.
Lời giải:
Đáp án đúng là: B
Phương trình hóa học:
B. HNO3.
C. NaNO3.
D. KNO3.
Lời giải:
Đáp án đúng là: B
Phương trình hóa học:
B. Ca(OH)2.
C. CaCO3.
D. CaSO4.
Lời giải:
Đáp án đúng là: C
Phương trình hóa học: 2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2
Ca(NO3)2 cung cấp N cho cây trồng.
B. 1.
C. 3.
D. 2.
Lời giải:
Đáp án đúng là: C
Các phản ứng trong đó HNO3 đóng vai trò là acid là:
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2
NH3 + HNO3 → NH4NO3
NaOH + HNO3 → NaNO3 + H2O
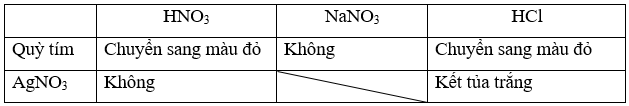
b) Trình bày phương pháp hoá học phân biệt ba dung dịch: HNO3, NaNO3, HCl.
a) Các phương trình hoá học:
b) Sử dụng lần lượt hai thuốc thử là quỳ tím và dung dịch silver nitrate như sau:
Phương trình hóa học:
AgNO3 + HCl → AgCl↓ + HNO3
Bài 6.22 trang 25 SBT Hóa học 11: Xét các phản ứng tạo thành oxide của nitrogen:
a) Hãy cho biết phản ứng nào toả nhiệt, phản ứng nào thu nhiệt.
b) Hãy tính của phản ứng:
Từ kết quả thu được, hãy tính của NO2 (g)
Lời giải:
a) Phản ứng thứ nhất thu nhiệt, phản ứng thứ hai tỏa nhiệt.
b)
Nhiệt tạo thành của NO2(g) là biến thiên enthalpy của phản ứng:
Như vậy,
Lời giải:
Bước 1: Cân hợp kim, ghi khối lượng m1.
Bước 2: Ngâm hợp kim vào cốc đựng dung dịch HNO3 20% dư để hòa tan Ag, còn lại Au không tan (thực hiện trong tủ hút).
Bước 3: Lọc lấy phần chất rắn không tan, rửa và làm khô.
Bước 4: Cân khối lượng vàng thu được, ghi khối lượng m2, tính gần đúng hàm lượng vàng trong hợp kim theo công thức:
Bài 6.24 trang 25 SBT Hóa học 11: Xét phản ứng:
Lời giải:
Vậy, phản ứng trên là phản ứng thu nhiệt.
Giai đoạn 1: Oxi hoá NH3 thành NO.
Nung nóng hỗn hợp gồm 1 phần thể tích ammonia và 9 phần thể tích không khí tới nhiệt độ khoảng 900oC (xúc tác Pt-Rh):
Giai đoạn 2: Oxi hoá NO thành NO2.
Dẫn hỗn hợp khí sau giai đoạn 1 qua hệ thống làm mát để hạ nhiệt độ:
Giai đoạn 3: Tổng hợp nitric acid.
Khí NO sinh ra ở giai đoạn 3 được dẫn quay về giai đoạn 2 của chu trình sản xuất.
a) Xác định chất khử, chất oxi hoá trong 3 giai đoạn sản xuất trên.
b) Tại sao ban đầu cần trộn ammonia với không khí theo tỉ lệ thể tích 1:9 ? (Biết không khí chứa 21% thể tích oxygen.)
Lời giải:
a) (1)
Chất oxi hóa là O2, chất khử là NH3.
(2)
Chất oxi hóa là O2, chất khử là NO.
(3)
NO2 vừa là chất khử vừa là chất oxi hóa.
b) Tổ hợp phản ứng của 3 giai đoạn: (1).3 + (2).6 + (3).4, thu được phản ứng chung:
12NH3 + 21O2 → 8HNO3 + 4NO + 14H2O
Tỉ lệ thể tích NH3 : O2 =
Tỉ lệ thể tích NH3 : Không khí gần bằng 1 : 9 (có lấy dư không khí).
Lý thuyết Một số hợp chất của nitrogen với oxygen
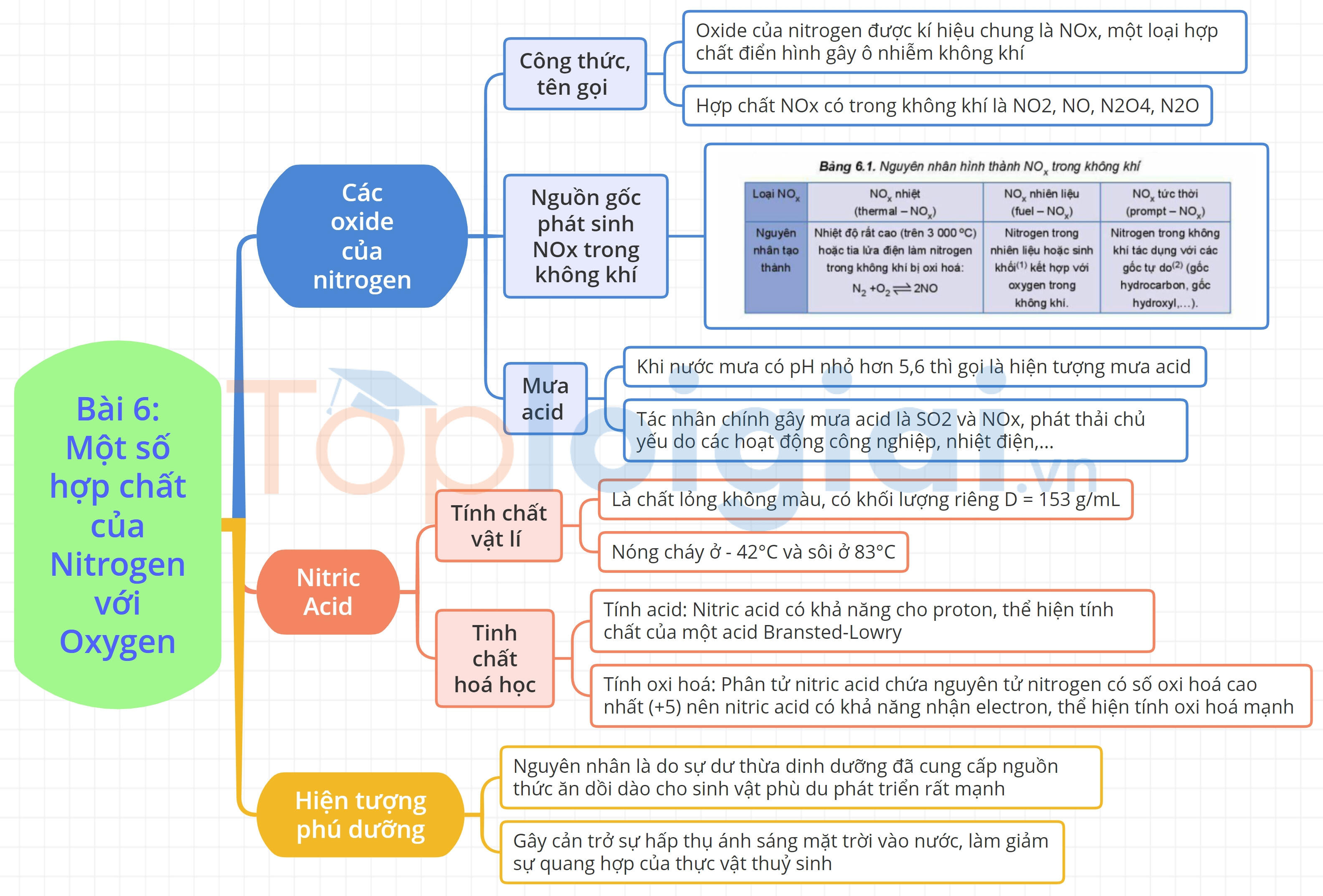
I. Các oxide của nitrogen
1. Công thức, tên gọi
- Công thức chung: NOx.
|
Oxide |
N2O |
NO |
NO2 |
N2O4 |
|
Tên gọi |
Dinitrogen oxide |
Nitrogen monoxide |
Nitrogen dioxide |
Dinitrogen tetroxide |
2. Nguồn gốc phát sinh NOx trong không khí.
- Tự nhiên: Núi lửa phun trào, cháy rừng, mưa dông kèm sấm sét.
- Con người: do hoạt động của con người: giao thông vân tải, sản xuất công nghiệp, nông nghiệp…
Tác hại: Là nguyên nhân gây mưa acid, sương mù quang hóa, hiệu ứng nhà kính, thủng tầng ozon…
3. Mưa acid
- Mưa acid là hiện tượng nước mưa có pH nhỏ hơn 5,6.
- Tác nhân: SO2 và NOx.
- VD:
2SO2 + O2 + 2H2O → 2H2SO4
4NO2 + O2 + 2H2O → 4HNO3
- Tác hại: Gây ảnh hướng xấu đến môi trường, con người và sinh vật như: ăn mòn các công trình kiến trúc, xây dựng …
II. Nitric acid
1. Cấu tạo
- Nguyên tử N có số oxi hóa +5, số oxi hóa cao nhất của nitrogen.
- Liên kết O-H phân cực mạnh về phía nguyên tử oxygen.
- Liên kết N → O là liên kết cho nhận
2. Tính chất vật lí
- Nitric acid tinh khiết là chất lỏng, không màu, có khối lượng riêng D = 1,53 g/ml. Nitric acid bốc khói mạnh trong không khí ẩm và tan vô hạn trong nước.
3. Tính chất hóa học
a, Tính acid
- Thể hiện tính chất hóa học của một acid.
- Trong công nghiệp, sản xuất phân bón giàu dinh dưỡng như ammonium nitrat, calcium nitrate.
NH3 + HNO3 → NH4NO3
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O
b, Tính oxi hóa
- Acid nitric có tính oxi hóa mạnh.
III. Hiện tượng phú dưỡng
- Nguyên nhân: Do sự dư thừa dinh dưỡng đã cung cấp nguồn thức ăn dồi dào cho sinh vật phù du phát triển rất mạnh.
- Tác hại: Gây cản trở sự hấp thụ ánh sáng mặt trời vào nước, làm giảm sự quang hợp của thực vật thủy sinh; tạo ra sự dư thừa dinh dưỡng.
Sơ đồ tư duy Một số hợp chất của nitrogen với oxygen
Xem thêm các bài giải SBT Hóa học 11 sách Kết nối tri thức hay, chi tiết khác:
Bài 7: Sulfur và sulfur dioxide
Bài 8: Sulfuric acid và muối sulfate
Xem thêm các chương trình khác:
- Soạn văn lớp 11 Kết nối tri thức - hay nhất
- Văn mẫu lớp 11 - Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn 11 – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn 11 - Kết nối tri thức
- Giải SBT Ngữ văn 11 – Kết nối tri thức
- Bố cục tác phẩm Ngữ văn 11 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 11 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 11 – Kết nối tri thức
- Soạn văn 11 Kết nối tri thức (ngắn nhất)
- Giải sgk Toán 11 – Kết nối tri thức
- Giải Chuyên đề học tập Toán 11 – Kết nối tri thức
- Lý thuyết Toán 11 - Kết nối tri thức
- Giải sbt Toán 11 – Kết nối tri thức
- Bài tập Tiếng Anh 11 Global success theo Unit có đáp án
- Giải sgk Tiếng Anh 11 – Global success
- Giải sbt Tiếng Anh 11 - Global Success
- Trọn bộ Từ vựng Tiếng Anh 11 Global success đầy đủ nhất
- Ngữ pháp Tiếng Anh 11 Global success
- Giải sgk Vật lí 11 – Kết nối tri thức
- Lý thuyết Vật lí 11 – Kết nối tri thức
- Giải sbt Vật lí 11 – Kết nối tri thức
- Giải Chuyên đề học tập Vật lí 11 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 11 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 11 – Kết nối tri thức
- Lý thuyết Sinh học 11 – Kết nối tri thức
- Giải Chuyên đề học tập Sinh học 11 – Kết nối tri thức
- Giải sbt Sinh học 11 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 11 – Kết nối tri thức
- Giải Chuyên đề học tập Kinh tế pháp luật 11 – Kết nối tri thức
- Lý thuyết Kinh tế pháp luật 11 – Kết nối tri thức
- Giải sbt Kinh tế pháp luật 11 – Kết nối tri thức
- Giải sgk Lịch sử 11 – Kết nối tri thức
- Giải Chuyên đề học tập Lịch sử 11 – Kết nối tri thức
- Lý thuyết Lịch sử 11 - Kết nối tri thức
- Giải sbt Lịch sử 11 – Kết nối tri thức
- Giải sgk Địa lí 11 – Kết nối tri thức
- Giải Chuyên đề học tập Địa lí 11 – Kết nối tri thức
- Lý thuyết Địa lí 11 - Kết nối tri thức
- Giải sbt Địa lí 11 – Kết nối tri thức
- Giải sgk Công nghệ 11 – Kết nối tri thức
- Lý thuyết Công nghệ 11 - Kết nối tri thức
- Giải sbt Công nghệ 11 – Kết nối tri thức
- Giải sgk Tin học 11 – Kết nối tri thức
- Giải Chuyên đề học tập Tin học 11 – Kết nối tri thức
- Lý thuyết Tin học 11 - Kết nối tri thức
- Giải sbt Tin học 11 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng an ninh 11 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 11 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 11 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 11 – Kết nối tri thức