Giáo án điện tử KHTN 8 Bài 11 (Kết nối tri thức): Muối
Với Giáo án PPT Bài 11: Muối KHTN 8 sách Kết nối tri thức sẽ giúp thầy cô dễ dàng biên soạn và giảng dạy bằng giáo án điện tử hay POWERPOINT Khoa học tự nhiên 8.
Chỉ 500k mua trọn bộ Giáo án KHTN 8 Kết nối tri thức bản PPT trình bày đẹp mắt (Chỉ 50k cho 1 bài giảng bất kì):
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận giáo án.
Xem thử tài liệu tại đây: Link tài liệu
Bài giảng điện tử Khoa học tự nhiên 8 Bài 11: Muối







.....................................
.....................................
.....................................
Tài liệu có 37 trang, trên đây trình bày tóm tắt 10 trang của Giáo án POWERPOINT KHTN 8 Kết nối tri thức Bài 11: Muối.
Giáo án Khoa học tự nhiên 8 Bài 11: Muối
I. Mục tiêu
1. Về kiến thức
- Nêu được khái niệm về muối, đọc được tên một số loại muối thông dụng và trình bày được một số phương pháp điều chế muối
- Chỉ ra được một số muối tan và muối không tan từ bảng tính tan.
- Tiến hành được thí nghiệm muối phản ứng với kim loại, acid, base, muối; nêu và giải thích được hiện tượng xảy ra trong thí nghiệm và rút ra kết luận về tính chất hóa học của muối.
- Trình bày được mối quan hệ giữa acid, base, oxide và muối và rút ra được kết luận về tính chất hóa học của acid, base, oxide.
2. Về năng lực
2.1.Năng lực chung.
- Năng lực tự chủ và tự học: tìm kiếm thông tin, đọc sách giáo khoa để tìm hiểu về khái niệm, tính chất hóa học, tính tan, điều chế muối.
- Năng lực giao tiếp và hợp tác: thảo luận nhóm để thực hiện các nhiệm vụ học tập.
- Năng lực giải quyết vấn đề và sáng tạo: giải quyết vấn đề trong thực hiện các nhiệm vụ học tập.
2.2. Năng lực khoa học tự nhiên
- Năng lực nhận biết KHTN: Biết được khái niệm, tính chất hóa học tính tan, điều chế muối.
- Năng lực tìm hiểu tự nhiên: Nắm được mối quan hệ giữa các hợp chất vô cơ với nhau.
- Vận dụng kiến thức, kỹ năng đã học: Vận dụng những hiểu biết về muối và mối quan hệ giữa các hợp chất vô cơ để giải thích được những vấn đề trong thực tiễn đời sống.
3. Phẩm chất
- Chăm học, chịu khó tìm tòi tài liệu và thực hiện các nhiệm vụ cá nhân nhằm tìm hiểu khái niệm, tính chất của muối.
- Có trách nhiệm trong hoạt động nhóm, chủ động nhận và thực hiện nhiệm vụ mà GV yêu cầu.
- Trung thực, trách nhiệm trong báo cáo kết quả các họa động và kiểm ra đánh giá.
II. Thiết bị dạy học và học liệu
1. Chuẩn bị của giáo viên
- Giáo án, slide, máy tính, máy chiếu, phiếu học tập.
- 5 bộ dụng cụ - hoá chất. Số lượng 01 bộ gồm:
+ Dụng cụ: 4 ống nghiệm, ống hút nhỏ giọt, giá để ống nghiệm.
+ Hóa chất: dd H2SO4 loãng, dd NaOH, dd CuSO4, ddNa2SO4, dd BaCl2, đinh sắt.
2. Chuẩn bị của học sinh
- Vở ghi + SGK + Đồ dùng học tập.
- Ôn tập bài cũ và chuẩn bị bài mới.
III. Tiến trình dạy học
1. Hoạt động 1: Mở đầu
a. Mục tiêu: Giúp học sinh xác định được vấn đề cần học tập, tạo tâm thế hứng thú, sẵn sàng tìm hiểu kiến thức mới.
b. Nội dung: Học sinh hoạt động cá nhân trả lời câu hỏi của GV.
Muối có rất nhiều ứng dụng trong đời sống như làm phân bón, bảo quản thực phẩm, làm bột nở cho các loại bánh, gia vị,… Muối có những tính chất hoá học nào và được điều chế như thế nào?
c. Sản phẩm: Câu trả lời của học sinh. Dự kiến:
- Một số tính chất hoá học của muối:
+ Dung dịch muối tác dụng với kim loại;
+ Muối tác dụng với dung dịch acid;
+ Dung dịch muối tác dụng với dung dịch base;
+ Dung dịch muối tác dụng với dung dịch muối.
- Muối có thể được điều chế bằng một số phương pháp như:
+ Dung dịch acid tác dụng với base;
+ Dung dịch acid tác dụng với oxide base;
+ Dung dịch acid tác dụng với muối;
+ Oxide acid tác dụng với dung dịch base;
+ Dung dịch muối tác dụng với dung dịch muối.
d. Tổ chức thực hiện:
Bước 1: GV chuyển giao nhiệm vụ học tập
- GV chiếu câu hỏi cho HS hoạt động cá nhân.
Bước 2: HS thực hiện nhiệm vụ học tập
HS hoạt động cá nhân suy nghĩ trả lời câu hỏi.
Bước 3: Báo cáo kết quả hoạt động và thảo luận
GV gọi Hs trả lời câu hỏi, Hs khác nhận xét bổ sung.
Bước 4. Đánh giá kết quả thực hiện nhiệm vụ
- GV nhận xét, ghi nhận các ý kiến của HS.
- GV chưa chốt kiến thức mà dẫn dắt vào bài học mới: Để giải thích câu hỏi này đầy đủ và chính xác, chúng ta cùng đi vào bài học ngày hôm nay.
2. Hoạt động 2: Hình thành kiến thức mới
Hoạt động 2.1: Tìm hiểu khái niệm muối.
a. Mục tiêu: Nêu được khái niệm về muối, đọc được tên một số loại muối thông dụng và trình bày được một số phương pháp điều chế muối
b. Nội dung:
- HS hoạt động cá nhân nghiên cứu thông tin SGK và thông tin Bảng 11.1 SGK/48
- HS thảo luận nhóm theo bàn thực hiện nhiệm vụ học tập theo yêu cầu của GV.
PHIẾU HỌC TẬP SỐ 1
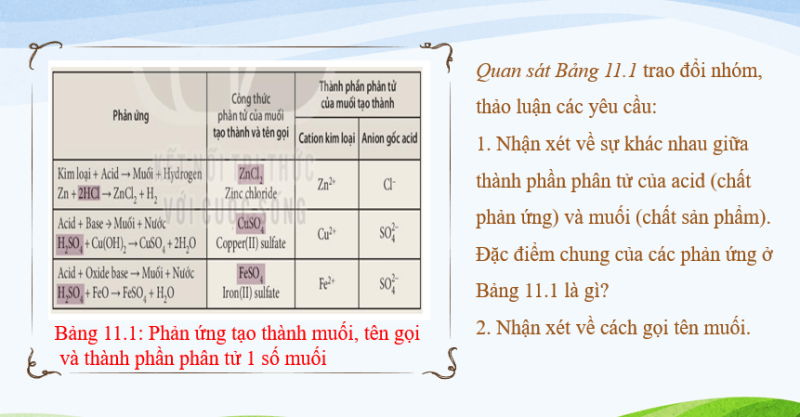
Câu 1: Quan sát Bảng 11.1 và thực hiện các yêu cầu:
1. Nhận xét về sự khác nhau giữa thành phần phân tử của acid (chất phản ứng) và muối (chất sản phẩm). Đặc điểm chung của các phản ứng ở Bảng 11.1 là gì?
2. Nhận xét về cách gọi tên muối.
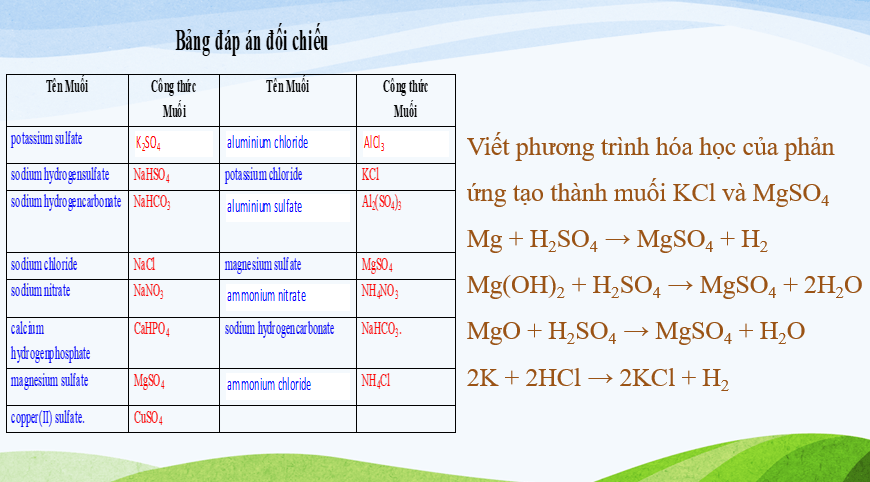
Câu 2: Viết công thức của các muối sau: potassium sulfate, sodium hydrogensulfate, sodium hydrogencarbonate, sodium chloride, sodium nitrate, calcium hydrogenphosphate, magnesium sulfate, copper(II) sulfate.
Câu 3: Gọi tên các muối sau: AlCl3; KCl; Al2(SO4)3; MgSO4; NH4NO3; NaHCO3.
Câu 4: Viết phương trình hoá học của phản ứng tạo thành muối KCl và MgSO4.
c. Sản phẩm: Kết quả hoạt động của HS. Dự kiến:
Câu 1:
1, Điểm khác nhau giữa thành phần phân tử của acid (chất phản ứng) và muối (chất sản phẩm) là phần tử mang điện dương (cation).
Điểm chung của các phản ứng ở Bảng 11.1 là đều có sự thay thế ion H+ của acid bằng ion kim loại.
2. Cách gọi tên muối gồm có cation kim loại và anion gốc acid:
Tên kim loại (hoá trị, đối với kim loại có nhiều hoá trị) + tên gốc acid.
Câu 2: Potassium sulfate: K2SO4;
Sodium hydrogensulfate: NaHSO4;
Sodium hydrogencarbonate: NaHCO3;
Sodium chloride: NaCl;
Sodium nitrate: NaNO3;
Calcium hydrogenphosphate: CaHPO4;
Magnesium sulfate: MgSO4;
Copper(II) sulfate: CuSO4.
Câu 3: AlCl3: aluminium chloride;
KCl: potassium chloride;
Al2(SO4)3: aluminium sulfate;
MgSO4: magnesium sulfate;
NH4NO3: ammonium nitrate;
NaHCO3: sodium hydrogencarbonate.
Câu 4:
- Một số phương trình hoá học của phản ứng tạo thành muối KCl:
2K + 2HCl → 2KCl + H2
KOH + HCl → KCl + H2O
K2O + 2HCl → 2KCl + H2O
K2CO3 + 2HCl → 2KCl + CO2 + H2O.
- Một số phương trình hoá học của phản ứng tạo thành muối MgSO4:
Mg + H2SO4 → MgSO4 + H2
Mg(OH)2 + H2SO4 → MgSO4 + 2H2O
MgO + H2SO4 → MgSO4 + H2O
MgCO3 + H2SO4 → MgSO4 + CO2 + H2O.
................................................
................................................
................................................
Xem thử tài liệu tại đây: Link tài liệu
Xem thêm các chương trình khác:
- Giáo án Khoa học tự nhiên 8 Cánh diều (mới nhất)
- Giáo án Toán 8 Cánh diều (mới nhất)
- Giáo án Ngữ văn 8 Cánh diều (mới nhất)
- Giáo án Lịch sử 8 Cánh diều (mới nhất)
- Giáo án Địa lí 8 Cánh diều (mới nhất)
- Giáo án PPT Toán 8 Cánh diều
- Giáo án PPT Địa lí 8 Cánh diều
- Giáo án Tin học 8 Cánh diều (mới nhất)
- Giáo án PPT Ngữ văn 8 Cánh diều
- Giáo án Công nghệ 8 Cánh diều (mới nhất)
- Giáo án Mĩ thuật 8 Cánh diều (mới nhất)
- Giáo án Giáo dục công dân 8 Cánh diều (mới nhất)
- Giáo án PPT Lịch sử 8 Cánh diều
- Giáo án PPT Khoa học tự nhiên 8 Cánh diều
- Giáo án Toán 8 Chân trời sáng tạo (mới nhất)
- Giáo án Ngữ văn 8 Chân trời sáng tạo (mới nhất)
- Giáo án Khoa học tự nhiên 8 Chân trời sáng tạo (mới nhất)
- Giáo án Lịch sử 8 Chân trời sáng tạo (mới nhất)
- Giáo án Địa lí 8 Chân trời sáng tạo (mới nhất)
- Giáo án PPT Toán 8 Chân trời sáng tạo
- Giáo án PPT Địa lí 8 Chân trời sáng tạo
- Giáo án PPT Ngữ văn 8 Chân trời sáng tạo
- Giáo án Tin học 8 Chân trời sáng tạo (mới nhất)
- Giáo án Công nghệ 8 Chân trời sáng tạo (mới nhất)
- Giáo án Mĩ thuật 8 (Bản 1) Chân trời sáng tạo (mới nhất)
- Giáo án Mĩ thuật 8 (Bản 2) Chân trời sáng tạo (mới nhất)
- Giáo án Giáo dục công dân 8 Chân trời sáng tạo (mới nhất)
- Giáo án PPT Lịch sử 8 Chân trời sáng tạo
