Giáo án điện tử KHTN 8 Bài 7 (Kết nối tri thức): Tốc độ phản ứng và chất xúc tác
Với Giáo án PPT Bài 7: Tốc độ phản ứng và chất xúc tác KHTN 8 sách Kết nối tri thức sẽ giúp thầy cô dễ dàng biên soạn và giảng dạy bằng giáo án điện tử hay POWERPOINT Khoa học tự nhiên 8.
Chỉ 500k mua trọn bộ Giáo án KHTN 8 Kết nối tri thức bản PPT trình bày đẹp mắt (Chỉ 50k cho 1 bài giảng bất kì):
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận giáo án.
Xem thử tài liệu tại đây: Link tài liệu
Bài giảng điện tử Khoa học tự nhiên 8 Bài 7: Tốc độ phản ứng và chất xúc tác







.....................................
.....................................
.....................................
Tài liệu có 15 trang, trên đây trình bày tóm tắt 10 trang của Giáo án POWERPOINT KHTN 8 Kết nối tri thức Bài 7: Tốc độ phản ứng và chất xúc tác.
Giáo án Khoa học tự nhiên 8 Bài 7: Tốc độ phản ứng và chất xúc tác
I. Mục tiêu
1. Về kiến thức
- Nêu được khái niệm về tốc độ phản ứng (chỉ mức độ nhanh hay chậm của phản ứng hóa học).
- Trình bày được một số yếu tố ảnh hưởng đến tốc độ phản ứng và nêu được một số ứng dụng thực tế.
- Tiến hành được thí nghiệm và quan sát thực tiễn:
+ So sánh được tốc độ một số phản ứng hóa học.
+ Nêu được các yếu tố làm thay đổi tốc độ phản ứng.
+ Nêu được khái niệm về chất xúc tác.
2. Về năng lực
2.1. Năng lực chung.
- Năng lực tự chủ và tự học: tìm kiếm thông tin, đọc sách giáo khoa để tìm hiểu về khái niệm tốc độ phản ứng hóa học và các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học.
- Năng lực giao tiếp và hợp tác: thảo luận nhóm để thực hiện các nhiệm vụ học tập.
- Năng lực giải quyết vấn đề và sáng tạo: giải quyết vấn đề trong thực hiện các nhiệm vụ học tập.
2.2. Năng lực khoa học tự nhiên
- Năng lực nhận biết KHTN: Biết tốc độ phản ứng là đại lượng đặc trưng cho khả năng phản ứng nhanh hay chậm của một phản ứng hóa học, một số yếu tố cụ thể ảnh hưởng đến tốc độ của một phản ứng hóa học.
- Năng lực tìm hiểu tự nhiên: Nắm được một số yếu tố ảnh hưởng đến tốc độ của một số phản ứng hóa học cụ thể.
- Vận dụng kiến thức, kỹ năng đã học: Vận dụng kiến thức để giải thích được khả năng xảy ra nhanh hay chậm của một số phản ứng hóa học trong thực tế đời sống.
3. Phẩm chất
- Chăm học, chịu khó tìm tòi tài liệu và thực hiện các nhiệm vụ cá nhân nhằm tìm hiểu khái niệm về tốc độ phản ứng hóa học và một số yếu tố ảnh hưởng đến tốc độ của một phản ứng hóa học..
- Có trách nhiệm trong hoạt động nhóm, chủ động nhận và thực hiện nhiệm vụ mà GV yêu cầu.
- Trung thực, trách nhiệm trong báo cáo kết quả các họa động và kiểm ra đánh giá.
II. Thiết bị dạy học và học liệu
1. Chuẩn bị của giáo viên
- Slide, giáo án, máy tính, máy chiếu.
- 5 bộ dụng cụ thí nghiệm. Số lượng 01 bộ gồm:
+ Dụng cụ: 6 ống nghiệm, 2 cốc thuỷ tinh, giá để ống nghiệm, thìa thuỷ tinh.
- Hóa chất: dung dịch HCl 0,1M, dung dịch HCl 1M, đinh sắt, viên C sủi, đá vôi dạng viên, đá vôi dạng bột, nước oxy già (y tế) H2O2 3%, manganese dioxide (MnO2, dạng bột).
2. Chuẩn bị của học sinh
- Vở ghi + SGK + Đồ dùng học tập.
- Ôn tập bài cũ và chuẩn bị bài mới trước khi đến lớp.
III. Tiến trình dạy học
1. Hoạt động 1: Mở đầu
a. Mục tiêu: Giúp học sinh xác định được vấn đề cần học tập, tạo tâm thế hứng thú, sẵn sàng tìm hiểu kiến thức mới.
b. Nội dung: Học sinh hoạt động cá nhân trả lời câu hỏi của GV.
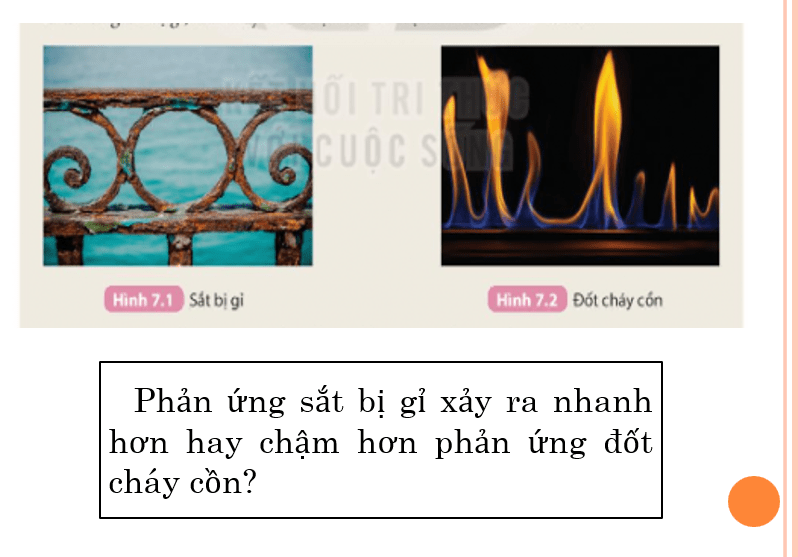
Có những phản ứng xảy ra rất nhanh, quan sát được ngay như phản ứng nổ, cháy, … và có những phản ứng xảy ra chậm, sau một khoảng thời gian mới quan sát được như phản ứng tạo gỉ sắt, tinh bột lên men rượu, … Vậy dùng đại lượng nào để đặc trưng cho sự nhanh, chậm của một phản ứng? Yếu tố nào ảnh hưởng đến sự nhanh, chậm này?
c. Sản phẩm: Câu trả lời của học sinh. Dự kiến:
- Tốc độ phản ứng là đại lượng đặc trưng cho sự nhanh chậm của phản ứng hoá học.
- Một số yếu tố ảnh hưởng đến tốc độ phản ứng là: nồng độ, nhiệt độ, diện tích bề mặt tiếp xúc, chất xúc tác…
d. Tổ chức thực hiện:
Bước 1: GV chuyển giao nhiệm vụ học tập
- GV cho HS quan sát Hình 7.1- Sắt bị gỉ và Hình 7.2 - Đốt cháy cồn.
GV chiếu câu hỏi cho HS hoạt động cá nhân.
- HS nhận nhiệm vụ.
Bước 2: HS thực hiện nhiệm vụ học tập
HS hoạt động cá nhân suy nghĩ trả lời câu hỏi.
Bước 3: Báo cáo kết quả hoạt động và thảo luận
GV gọi Hs trả lời câu hỏi, Hs khác nhận xét bổ sung
Bước 4. Đánh giá kết quả thực hiện nhiệm vụ
- GV nhận xét, ghi nhận các ý kiến của HS.
- GV chưa chốt kiến thức mà dẫn dắt vào bài học mới: Để giải thích câu hỏi này đầy đủ và chính xác, chúng ta cùng đi vào bài học ngày hôm nay
2. Hoạt động 2: Hình thành kiến thức mới
Hoạt động 2.1: Tìm hiểu khái niệm tốc độ phản ứng.
a. Mục tiêu: Nêu được khái niệm về tốc độ phản ứng (chỉ mức độ nhanh hay chậm của phản ứng hóa học).
b. Nội dung:
- HS hoạt động cá nhân nghiên cứu thông tin SGK/31, rút ra khái niệm tốc độ phản ứng và lấy ví dụ.
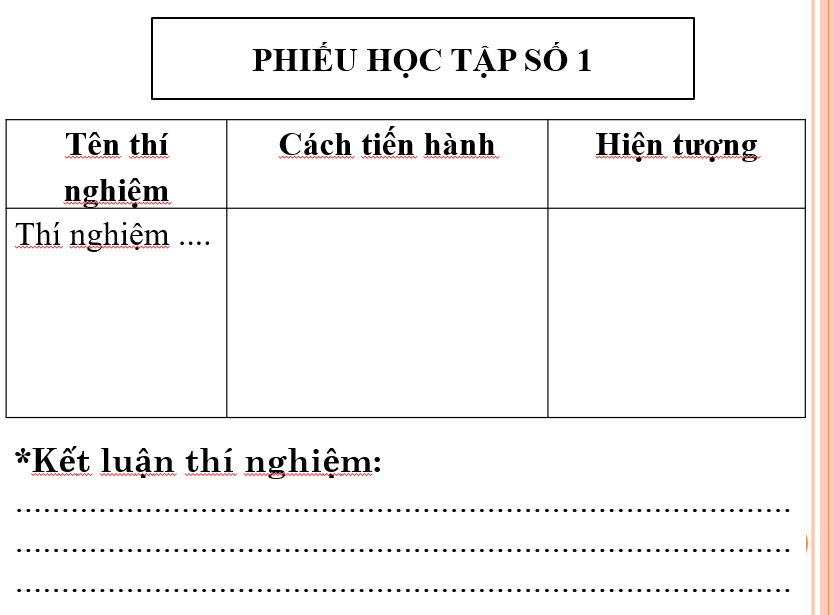
- HS thảo luận cặp đôi thực hiện nhiệm vụ phiếu học tập số 1 theo yêu cầu của GV.
PHIẾU HỌC TẬP SỐ 1
Một học sinh thực hiện thí nghiệm và ghi lại hiện tượng như sau:
Cho cùng một lượng hydrochloric acid vào hai ống nghiệm đựng cùng một lượng đá vôi ở dạng bột (ống nghiệm (1)) và dạng viên (ống nghiệm (2)). Quan sát hiện tượng thấy rằng ở ống nghiệm (1) bọt khí xuất hiện nhiều hơn và đá vôi tan hết trước.
Phản ứng giữa hydrochloric acid với đá vôi dạng bột xảy ra nhanh hơn hay chậm hơn so với phản ứng giữa hydrochloric acid với đá vôi dạng viên?
c. Sản phẩm: Kết quả hoạt động của HS. Dự kiến:
Phản ứng giữa hydrochloric acid với đá vôi dạng bột xảy ra nhanh hơn so với phản ứng giữa hydrochloric acid với đá vôi dạng viên.
d. Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV - HS |
NỘI DUNG |
|
Bước 1: GV chuyển giao nhiệm vụ học tập - GV cho HS cá nhân nghiên cứu thông tin phần I SGK/31, rút ra khái niệm về tốc độ phản ứng và lấy ví dụ cụ thể trong đời sống để minh họa. - HS hoạt động cặp thực hiện phiếu học tập số 1. Bước 2: HS thực hiện nhiệm vụ học tập - HS nghiên cứu thông tin phần I SGK/31 - HS rút ra khái niệm tốc độ phản ứng và lấy ví dụ. - HS thảo luận cặp đôi thực hiện nhiệm vụ học tập. Bước 3: Báo cáo kết quả hoạt động và thảo luận - HS đưa ra khái niệm tốc độ phản ứng và lấy ví dụ. - HS đại diện các nhóm báo cáo kết quả. - HS các nhóm khác theo dõi, bổ sung. Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập GV nhận xét đánh giá và chốt nội dung kiến thức. |
I. Khái niệm tốc độ phản ứng - Tốc độ phản ứng là đại lượng đặc trưng cho sự nhanh, chậm của phản ứng hóa học. - Ví dụ: + Phản ứng đốt cháy xăng dầu, gas… xảy ra nhanh → Tốc độ rất nhanh. + Phản ứng giữa sắt với khí oxygen tạo gỉ sắt… xảy ra chậm → Tốc độ chậm hơn.
|
................................................
................................................
................................................
Xem thử tài liệu tại đây: Link tài liệu
Xem thêm các chương trình khác:
- Giáo án Khoa học tự nhiên 8 Cánh diều (mới nhất)
- Giáo án Toán 8 Cánh diều (mới nhất)
- Giáo án Ngữ văn 8 Cánh diều (mới nhất)
- Giáo án Lịch sử 8 Cánh diều (mới nhất)
- Giáo án Địa lí 8 Cánh diều (mới nhất)
- Giáo án PPT Toán 8 Cánh diều
- Giáo án PPT Địa lí 8 Cánh diều
- Giáo án Tin học 8 Cánh diều (mới nhất)
- Giáo án PPT Ngữ văn 8 Cánh diều
- Giáo án Công nghệ 8 Cánh diều (mới nhất)
- Giáo án Mĩ thuật 8 Cánh diều (mới nhất)
- Giáo án Giáo dục công dân 8 Cánh diều (mới nhất)
- Giáo án PPT Lịch sử 8 Cánh diều
- Giáo án PPT Khoa học tự nhiên 8 Cánh diều
- Giáo án Toán 8 Chân trời sáng tạo (mới nhất)
- Giáo án Ngữ văn 8 Chân trời sáng tạo (mới nhất)
- Giáo án Khoa học tự nhiên 8 Chân trời sáng tạo (mới nhất)
- Giáo án Lịch sử 8 Chân trời sáng tạo (mới nhất)
- Giáo án Địa lí 8 Chân trời sáng tạo (mới nhất)
- Giáo án PPT Toán 8 Chân trời sáng tạo
- Giáo án PPT Địa lí 8 Chân trời sáng tạo
- Giáo án PPT Ngữ văn 8 Chân trời sáng tạo
- Giáo án Tin học 8 Chân trời sáng tạo (mới nhất)
- Giáo án Công nghệ 8 Chân trời sáng tạo (mới nhất)
- Giáo án Mĩ thuật 8 (Bản 1) Chân trời sáng tạo (mới nhất)
- Giáo án Mĩ thuật 8 (Bản 2) Chân trời sáng tạo (mới nhất)
- Giáo án Giáo dục công dân 8 Chân trời sáng tạo (mới nhất)
- Giáo án PPT Lịch sử 8 Chân trời sáng tạo
