Giáo án điện tử KHTN 8 Bài 10 (Kết nối tri thức): Oxide
Với Giáo án PPT Bài 10: Oxide KHTN 8 sách Kết nối tri thức sẽ giúp thầy cô dễ dàng biên soạn và giảng dạy bằng giáo án điện tử hay POWERPOINT Khoa học tự nhiên 8.
Chỉ 500k mua trọn bộ Giáo án KHTN 8 Kết nối tri thức bản PPT trình bày đẹp mắt (Chỉ 50k cho 1 bài giảng bất kì):
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận giáo án.
Xem thử tài liệu tại đây: Link tài liệu
Bài giảng điện tử Khoa học tự nhiên 8 Bài 10: Oxide









.....................................
.....................................
.....................................
Tài liệu có 31 trang, trên đây trình bày tóm tắt 10 trang của Giáo án POWERPOINT KHTN 8 Kết nối tri thức Bài 10: Oxide.
Giáo án Khoa học tự nhiên 8 Bài 10: Oxide
I. Mục tiêu
1. Về kiến thức
- Nêu được khái niệm oxide và phân loại được các oxide theo khả năng phản ứng với acid/base.
- Viết được phương trình hóa học tạo oxide từ kim loại/phi kim với oxygen.
- Tiến hành được thí nghiệm oxide kim loại phản ứng với acid; oxide phi kim phản ứng với base; nêu và giải thích hiện tượng xảy ra trong thí nghiệm và rút ra nhận xét về tính chất hóa học của oxide.
2. Về năng lực
2.1. Năng lực chung.
- Năng lực tự chủ và tự học: tìm kiếm thông tin, đọc sách giáo khoa để tìm hiểu về khái niệm, tính chất hóa học của oxide.
- Năng lực giao tiếp và hợp tác: thảo luận nhóm để thực hiện các nhiệm vụ học tập.
- Năng lực giải quyết vấn đề và sáng tạo: giải quyết vấn đề trong thực hiện các nhiệm vụ học tập.
2.2. Năng lực khoa học tự nhiên
- Năng lực nhận biết KHTN: Biết được khái niệm, tính chất hóa học của oxide
- Năng lực tìm hiểu tự nhiên: Nắm được tính chất của oxide và ứng dụng của một số oxide trong đời sống
- Vận dụng kiến thức, kỹ năng đã học: Vận dụng những hiểu biết về oxide để giải thích được những vấn đề liên quan đến oxide trong thực tiễn đời sống.
3. Phẩm chất
- Chăm học, chịu khó tìm tòi tài liệu và thực hiện các nhiệm vụ cá nhân nhằm tìm hiểu khái niệm, tính chất của oxide.
- Có trách nhiệm trong hoạt động nhóm, chủ động nhận và thực hiện nhiệm vụ mà GV yêu cầu.
- Trung thực, trách nhiệm trong báo cáo kết quả các họa động và kiểm ra đánh giá.
II. Thiết bị dạy học và học liệu
1. Chuẩn bị của giáo viên
- Giáo án, slide, máy tính, máy chiếu, phiếu học tập.
- 5 bộ dụng cụ thí nghiệm. Số lượng 01 bộ gồm:
+ Dụng cụ: 4 ống nghiệm, giá để ống nghiệm, ống hút nhỏ giọt, thìa lấy hoá chất, ống thuỷ tinh hình chữ L, nút cao su.
- Hóa chất: dd HCl, đá vôi (CaCO3), nước vôi trong (Ca(OH)2), CuO bột, dd H2SO4 loãng.
2. Chuẩn bị của học sinh
- Vở ghi + SGK + Đồ dùng học tập.
- Ôn tập bài cũ và chuẩn bị bài mới trước khi đến lớp.
III. Tiến trình dạy học
1. Hoạt động 1: Mở đầu
a. Mục tiêu: Giúp học sinh xác định được vấn đề cần học tập, tạo tâm thế hứng thú, sẵn sàng tìm hiểu kiến thức mới.
b. Nội dung: Học sinh hoạt động cá nhân trả lời câu hỏi của GV.
Tại sao vôi sống (CaO) lại được sử dụng để khử chua đất trồng trọt?
c. Sản phẩm: Câu trả lời của học sinh. Dự kiến:
Khi bón vôi sống (CaO) lên ruộng, vôi sống tác dụng với nước tạo thành Ca(OH)2:
CaO + H2O → Ca(OH)2.
Ca(OH)2 tác dụng với acid có trong đất, khử chua cho đất.
d. Tổ chức thực hiện:
Bước 1: GV chuyển giao nhiệm vụ học tập
- GV chiếu câu hỏi cho HS hoạt động cá nhân.
- HS nhận nhiệm vụ.
Bước 2: HS thực hiện nhiệm vụ học tập
HS hoạt động cá nhân suy nghĩ trả lời câu hỏi.
Bước 3: Báo cáo kết quả hoạt động và thảo luận
GV gọi Hs trả lời câu hỏi, Hs khác nhận xét bổ sung
Bước 4. Đánh giá kết quả thực hiện nhiệm vụ
- GV nhận xét, ghi nhận các ý kiến của HS.
- GV chưa chốt kiến thức mà dẫn dắt vào bài học mới: Để giải thích câu hỏi này đầy đủ và chính xác, chúng ta cùng đi vào bài học ngày hôm nay.
2. Hoạt động 2: Hình thành kiến thức mới
Hoạt động 2.1: Tìm hiểu khái niệm oxide.
a, Mục tiêu:
- Nêu được khái niệm oxide và phân loại được các oxide theo khả năng phản ứng với acid/base.
- Viết được phương trình hóa học tạo oxide từ kim loại/phi kim với oxygen.
b. Nội dung:
- HS hoạt động cá nhân nghiên cứu thông tin SGK và thông tin Bảng 10.1 SGK/44
- HS thảo luận nhóm theo bàn thực hiện nhiệm vụ học tập theo yêu cầu của GV.
PHIẾU HỌC TẬP SỐ 1
Câu 1. Quan sát bảng 10.1 SGK: Nhận xét thành phần nguyên tố trong công thức phân tử của các oxide ở cột (2), (4) và thực hiện các yêu cầu:
1. Đề xuất khái niệm về oxide.
2. Phân loại oxide.
Câu 2. Cho các sơ đồ phản ứng sau:
(1) .. ? .. + O2 −→ Al2O3
(2) P + .. ? .. −→ P2O5
(3) S + .. ? .. −→ SO2
(4) Mg + O2 −→ .. ? ..
Hoàn thành các phương trình hoá học và đọc tên các sản phẩm tạo thành.
c. Sản phẩm: Kết quả hoạt động của HS. Dự kiến:
Câu 1: Nhận xét: Công thức phân tử của các oxide ở cột (2), (4) đều có chứa 2 nguyên tố, trong đó có 1 nguyên tố là oxygen (O).
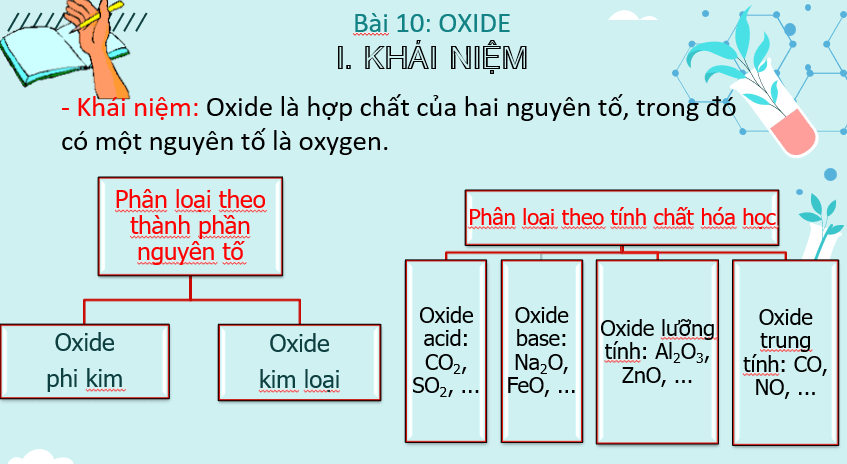
1. Khái niệm oxide: Oxide là hợp chất của hai nguyên tố trong đó có một nguyên tố là oxygen.
2. Phân loại oxide:
- Dựa vào thành phần nguyên tố, oxide có thể phân thành hai loại: oxide kim loại và oxide phi kim.
- Dựa vào tính chất hoá học, oxide có thể phân thành 4 loại: oxide acid; oxide base; oxide lưỡng tính và oxide trung tính.
Câu 2:
(1) 4Al + 3O2 → 2Al2O3 (aluminium oxide).
(2) 4P + 5O2 → 2P2O5 (diphosphorus pentoxide).
(3) S + O2 → SO2 (sulfur dioxide).
(4) 2Mg + O2 → 2MgO (magnesium oxide).
d. Tổ chức thực hiện:
|
HOẠT ĐỘNG CỦA GV - HS |
NỘI DUNG |
|
Bước 1: GV chuyển giao nhiệm vụ học tập - GV cho HS cá nhân nghiên cứu thông tin Bảng 10.1 SGK/44 - Tên, công thức hóa học của một số oxide. - HS hoạt động nhóm theo bàn, quan sát bảng 10.1 thực hiện câu hỏi 1 trong phiếu học tập. - GV cho HS hoạt động cá nhân nghiên cứu thông tin SGK và nêu cách gọi tên oxide - GV Cho HS hoạt động nhóm thực hiện câu hỏi 2 trong phiếu học tập. Bước 2: HS thực hiện nhiệm vụ học tập - HS nghiên cứu thông tin Bảng 10.1 SGK/44. - HS thảo luận nhóm theo thực hiện nhiệm vụ học tập. - HS nghiên cứu thông tin SGK/44 và nêu cách gọi tên oxide. - HS thảo luận nhóm thực hiện nhiệm vụ học tập Bước 3: Báo cáo kết quả hoạt động và thảo luận - HS đại diện các nhóm báo cáo kết quả thảo luận. - HS cá nhân nêu cách gọi tên oxide - HS đại diện nhóm báo cáo kết quả thảo luận - HS các nhóm khác theo dõi, bổ sung. Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập GV nhận xét đánh giá và chốt nội dung kiến thức. |
I. Khái niệm * Oxide là hợp chất của hai nguyên tố trong đó có một nguyên tố là oxygen. * Phân loại oxide: - Dựa vào thành phần nguyên tố: + Oxide kim loại: có thể được tạo thành từ phản ứng của kim loại với oxygen. Ví dụ: 4K + O2 → 2K2O + Oxide phi kim: có thể được tạo thành từ phản ứng của phi kim với oxygen. Ví dụ: 4P + 5O2 → 2P2O5 - Dựa vào tính chất hóa học: + Oxide acid: P2O5; SO2;CO2 + Oxide base: Na2O; K2O; MgO + Oxide lưỡng tính: Al2O3; ZnO + Oxide trung tính: CO; NO * Cách gọi tên: - Với nguyên tố chỉ có một hóa trị: Tên nguyên tố + oxide Ví dụ: Na2O: Sodium oxide. - Với nguyên tố có nhiều hóa trị: Tên nguyên tố (hóa trị của nguyên tố) + oxide. - Với oxide phi kim nhiều hóa trị: (Tiền tố chỉ số nguyên tử của nguyên tố) Tên nguyên tố + (tiền tố chỉ số nguyên tử oxygen) oxide. (Tiền tố mono là một, di là hai, tri là ba, tetra là bốn, penta là năm…) Ví dụ: Fe2O3: Iron (III) oxide. P2O5: diphosphorus pentoxide. CO2: Carbon dioxide hoặc carbon (IV) oxide. |
................................................
................................................
................................................
Xem thử tài liệu tại đây: Link tài liệu
Xem thêm các chương trình khác:
- Giáo án Khoa học tự nhiên 8 Cánh diều (mới nhất)
- Giáo án Toán 8 Cánh diều (mới nhất)
- Giáo án Ngữ văn 8 Cánh diều (mới nhất)
- Giáo án Lịch sử 8 Cánh diều (mới nhất)
- Giáo án Địa lí 8 Cánh diều (mới nhất)
- Giáo án PPT Toán 8 Cánh diều
- Giáo án PPT Địa lí 8 Cánh diều
- Giáo án Tin học 8 Cánh diều (mới nhất)
- Giáo án PPT Ngữ văn 8 Cánh diều
- Giáo án Công nghệ 8 Cánh diều (mới nhất)
- Giáo án Mĩ thuật 8 Cánh diều (mới nhất)
- Giáo án Giáo dục công dân 8 Cánh diều (mới nhất)
- Giáo án PPT Lịch sử 8 Cánh diều
- Giáo án PPT Khoa học tự nhiên 8 Cánh diều
- Giáo án Toán 8 Chân trời sáng tạo (mới nhất)
- Giáo án Ngữ văn 8 Chân trời sáng tạo (mới nhất)
- Giáo án Khoa học tự nhiên 8 Chân trời sáng tạo (mới nhất)
- Giáo án Lịch sử 8 Chân trời sáng tạo (mới nhất)
- Giáo án Địa lí 8 Chân trời sáng tạo (mới nhất)
- Giáo án PPT Toán 8 Chân trời sáng tạo
- Giáo án PPT Địa lí 8 Chân trời sáng tạo
- Giáo án PPT Ngữ văn 8 Chân trời sáng tạo
- Giáo án Tin học 8 Chân trời sáng tạo (mới nhất)
- Giáo án Công nghệ 8 Chân trời sáng tạo (mới nhất)
- Giáo án Mĩ thuật 8 (Bản 1) Chân trời sáng tạo (mới nhất)
- Giáo án Mĩ thuật 8 (Bản 2) Chân trời sáng tạo (mới nhất)
- Giáo án Giáo dục công dân 8 Chân trời sáng tạo (mới nhất)
- Giáo án PPT Lịch sử 8 Chân trời sáng tạo
