TOP 10 đề thi Giữa Học kì 2 Hóa học 10 (Kết nối tri thức) năm 2025 có đáp án
Bộ đề thi Giữa Học kì 2 Hóa học lớp 10 Kết nối tri thức (10 đề có đáp án + ma trận) năm 2025 chi tiết giúp học sinh ôn luyện để đạt điểm cao trong bài thi Hóa học 10 Giữa Học kì 2. Mời các bạn cùng đón xem:
Chỉ 60k mua trọn bộ Đề thi Hóa học 10 Kết nối tri thức bản word có lời giải chi tiết:
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận giáo án.
Xem thử tài liệu tại đây: Link tài liệu
Đề thi Giữa Học kì 2 Hóa học lớp 10 (Kết nối tri thức) năm 2025 có đáp án
Ma trận đề thi giữa kì 2 môn Hóa học 10 – Kết nối tri thức
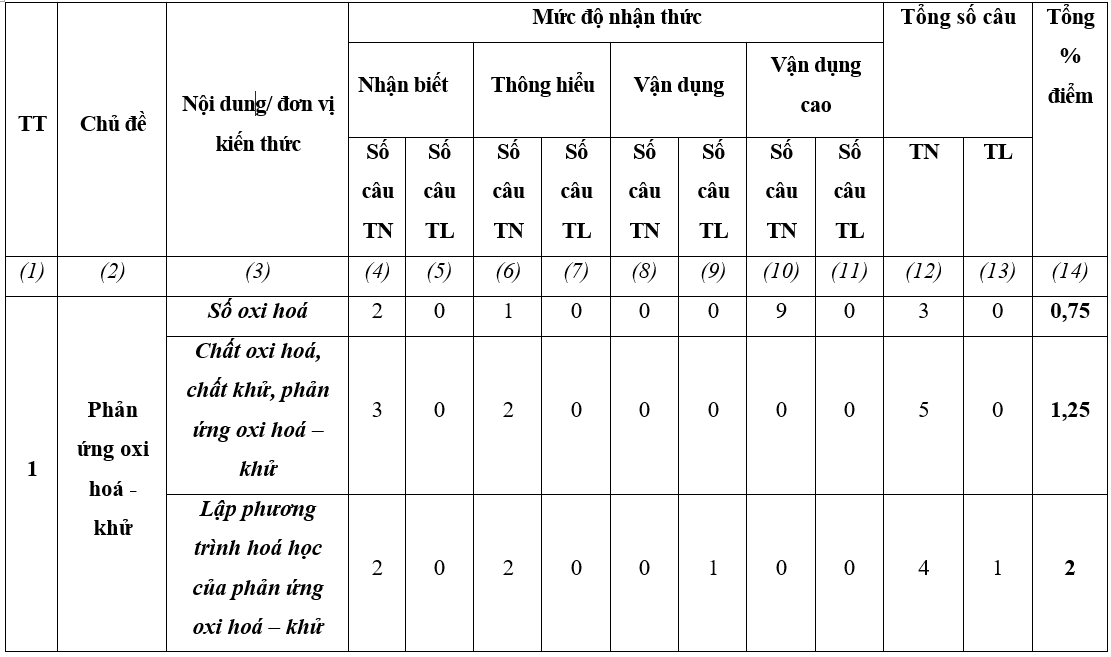
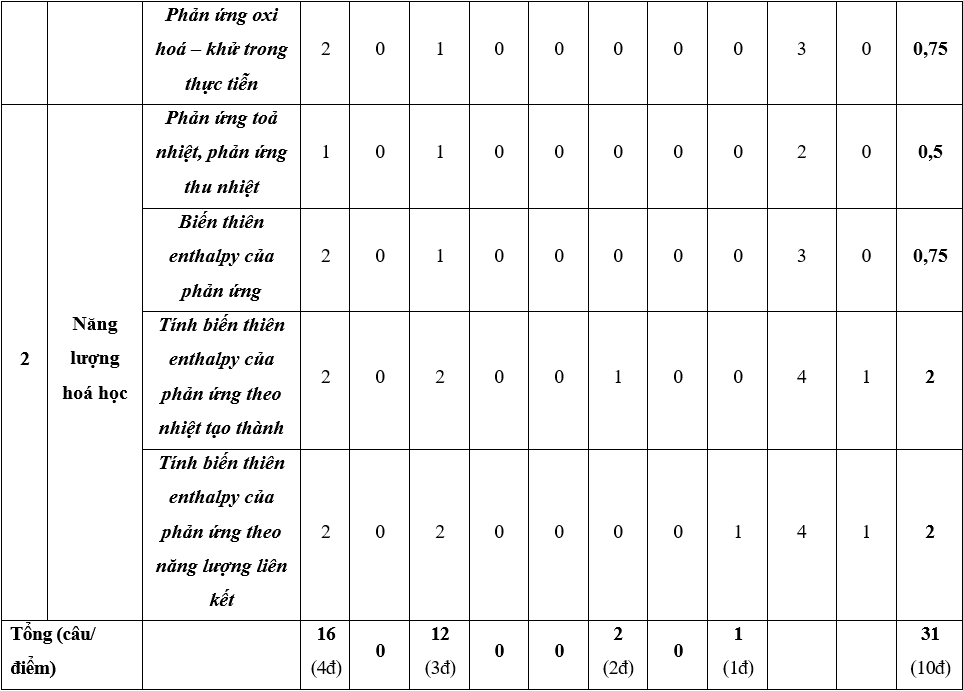
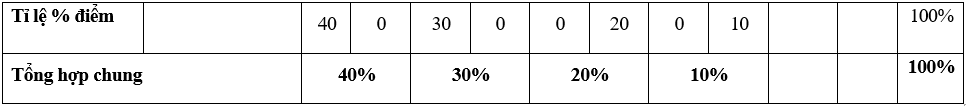
Lưu ý:
- Hình thức kiểm tra: Kết hợp giữa trắc nghiệm và tự luận (tỉ lệ 70% trắc nghiệm, 30% tự luận).
- Cấu trúc:
+ Mức độ đề: 40% Nhận biết; 30% Thông hiểu; 20% Vận dụng; 10% Vận dụng cao.
+ Phần trắc nghiệm: 28 câu, 7,0 điểm (gồm 16 câu ở mức độ nhận biết;12 câu ở mức độ thông hiểu), mỗi câu 0,25 điểm;
+ Phần tự luận: 3,0 điểm (Vận dụng: 02 câu, 2,0 điểm; Vận dụng cao: 1-2 câu, 1,0 điểm).
- Các câu hỏi ở mức độ nhận biết và thông hiểu là các câu hỏi trắc nghiệm khách quan 4 lựa chọn, trong đó có duy nhất 1 lựa chọn đúng; các câu hỏi ở mức độ vận dụng và vận dụng cao là các câu hỏi tự luận.
- Với các câu hỏi TNKQ ở mức độ nhận biết và mức độ thông hiểu, mỗi câu hỏi kiểm tra, đánh giá 01 yêu cầu cần đạt của chương trình.
- Không chọn câu ở mức độ vận dụng và câu ở mức độ vận dụng cao trong cùng một đơn vị kiến thức.
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Giữa Học kì 2
Năm học ...
Môn: Hóa học 10
Thời gian làm bài: 45 phút
Đề thi Giữa Học kì 2 Hóa học lớp 10 Kết nối tri thức có đáp án - (Đề số 1)
|
Sở GD- ĐT … TRƯỜNG THPT …
Mã đề thi: 001
|
ĐỀ KIỂM TRA GIỮA HỌC KÌ II Năm học ... Môn: Hóa học 10 Bộ: Kết nối tri thức với cuộc sống Thời gian làm bài: 45 phút; (28 câu trắc nghiệm – 3 câu tự luận) |
(Học sinh không được sử dụng tài liệu)
Họ, tên học sinh:..................................................................... Lớp: .............................
Đề bài:
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Phát biểu nào sau đây về số oxi hoá là không đúng?
A. Số oxi hoá được viết ở dạng đại số, dấu viết trước, số viết sau.
B. Trong đơn chất, số oxi hoá của nguyên tử bằng 0.
C. Trong ion đơn nguyên tử, số oxi hoá của nguyên tố bằng điện tích ion.
D. Trong tất cả các hợp chất, số oxi hoá của hydrogen là +1.
Câu 2: Số oxi hóa của magnesium trong MgCl2 là
A. +1. B. +2.
C. 0. D. -2.
Câu 3: Số oxi hoá của nitrogen trong NH4NO2 là
A. 0 và +3. B. +5.
C. +3. D. -3 và +3.
Câu 4: Phản ứng oxi hóa – khử là phản ứng có sự nhường và nhận
A. electron. B. neutron.
C. proton. D. cation.
Câu 5: Cho quá trình Fe2+ → Fe3+ + 1e, quá trình này còn được gọi là
A. quá trình oxi hóa.
B. quá trình khử.
C. quá trình nhận proton.
D. quá trình tự oxi hóa – khử.
Câu 6: Cho phản ứng: SO2 + Br2 + 2H2O → 2HBr + H2SO4. Trong phản ứng trên, vai trò của Br2 là
A. chất khử.
B. chất oxi hóa.
C. vừa là chất oxi hóa, vừa là chất tạo môi trường.
D. vừa là chất khử, vừa là chất tạo môi trường.
Câu 7: Phản ứng nào dưới đây thuộc loại phản ứng oxi hóa - khử?
A. AgNO3 + KBr → AgBr + KNO3.
B. Ba(OH)2 + H2SO4 → BaSO4 + 2H2O.
C. CH4 + 2O2 CO2 + 2H2O.
D. CaCO3 CaO + CO2.
Câu 8: Trong phản ứng: 4FeS2 + 11O2 2Fe2O3 + 8SO2, chất bị khử là
A. FeS2. B. O2.
C. Fe2O3. D. SO2.
Câu 9: Cho phản ứng: FeO + HNO3 → Fe(NO3)3 + NO + H2O. Trong phương trình hoá học của phản ứng trên, khi hệ số của FeO là 3 thì hệ số của HNO3 là
A. 6. B. 8.
C. 4. D. 10.
Câu 10: Cho phương trình hóa học (với a, b, c, d là các hệ số):
aFeSO4 + bCl2 → cFe2(SO4)3 + dFeCl3
Tỉ lệ a : c là
A. 4 : 1. B. 3 : 2.
C. 2 : 1. D. 3 : 1.
Câu 11: Cho phản ứng 3Cl2 + 6KOH 5KCl + KClO3 + 3H2O.
Tỉ lệ số nguyên tử chloride bị khử và số nguyên tử chloride bị oxi hoá tương ứng là
A. 1 : 2. B. 1 : 5.
C. 2 : 1. D. 5 : 1.
Câu 12: Cho 12,8 gram Cu tác dụng hết với lượng dư dung dịch H2SO4 đặc, nóng thu được V lít khí SO2 ở điều kiện chuẩn. Giá trị của V là
A. 4,958. B. 2,479.
C. 3,720. D. 0,297.
Câu 13: Cảnh sát giao thông sử dụng các dụng cụ phân tích rượu etylic có chứa CrO3. Khi tài xế hà hơi thở vào dụng cụ phân tích trên, nếu trong hơi thở có chứa hơi rượu thì hơi rượu sẽ tác dụng với CrO3 có màu da cam và biến thành Cr2O3 có màu xanh đen theo phản ứng hóa học sau:
CrO3 + C2H5OH → CO2↑ + Cr2O3 + H2O
Tỉ lệ chất khử : chất oxi hoá ở phương trình hóa học trên là
A. 1 : 1. B. 1 : 2.
C. 2 : 1. D. 1 : 3.
Câu 14: Sodium peroxide (Na2O2) là chất oxi hóa mạnh, dễ dàng hấp thụ khí carbon dioxide và giải phóng khí oxygen. Do đó, chúng được sử dụng trong bình lặn hoặc tàu ngầm để hấp thụ khí carbon dioxide và cung cấp khí oxygen cho con người trong hô hấp theo phản ứng sau: Na2O2 + CO2 → Na2CO3 + O2↑. Biết hệ số cân bằng của phản ứng là các số nguyên tối giản. Tổng hệ số cân bằng của chất tham gia phản ứng là
A. 2. B. 3.
C. 4. D. 5.
Câu 15: Cho các phát biểu sau, phát biểu đúng là
A. Trong phản ứng cháy, chất bị oxi hoá thường là oxygen.
B. Trong công nghiệp, tất cả các phản ứng hoá học trong quy trình sản xuất đều là phản ứng oxi hoá – khử.
C. Các phản ứng oxi hoá – khử trong đời sống đều có lợi.
D. Trong phản ứng đốt cháy khí thiên nhiên thì khí thiên nhiên đóng vai trò là chất bị oxi hoá.
Câu 16: Phản ứng toả nhiệt là
A. phản ứng hấp thụ năng lượng dưới dạng nhiệt.
B. phản ứng giải phóng năng lượng dưới dạng nhiệt.
C. phản ứng lấy nhiệt từ môi trường.
D. phản ứng làm nhiệt độ môi trường giảm đi.
Câu 17: Trong các phản ứng sau:
(1) Phản ứng đốt cháy than.
(2) Phản ứng nung vôi.
(3) Phản ứng nhiệt phân thuốc tím.
Phản ứng thu nhiệt là
A. (1). B. (1) và (2).
C. (2) và (3). D. (1), (2) và (3).
Câu 18: Biến thiên enthalpy của phản ứng được kí hiệu là
A. ∆fH. B. ∆sH.
C. ∆tH. D. ∆rH.
Câu 19: Phản ứng toả nhiệt thì
A. ∆rH = 0. B. ∆rH < 0.
C. ∆rH > 0. D. ∆rH ≥ 0.
Câu 20: Cho phương trình nhiệt hóa học của phản ứng
Phản ứng trên là phản ứng
A. thu nhiệt.
B. không có sự thay đổi năng lượng.
C. tỏa nhiệt.
D. có sự giải phóng nhiệt lượng ra môi trường.
Câu 21: Phát biểu nào sau đây về nhiệt tạo thành là không đúng?
A. Nhiệt tạo thành của một chất là biến thiên enthalpy của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền vững nhất, ở một điều kiện xác định.
B. Nhiệt tạo thành chuẩn là nhiệt tạo thành ở điều kiện chuẩn.
C. Nhiệt tạo thành chuẩn của các đơn chất ở dạng bền vững nhất bằng 0.
D. Kí hiệu nhiệt tạo thành chuẩn là
Câu 22: Ở điều kiện chuẩn, công thức tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành là
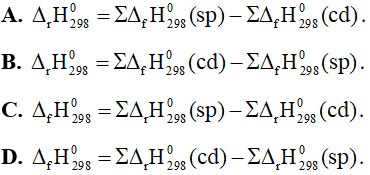
Câu 23: Dựa vào phương trình nhiệt hóa học của phản ứng sau:
Giá trị của phản ứng: là
A. – 26,32 kJ. B. + 13,16 kJ.
C. + 19,74 kJ. D. – 10,28 kJ.
Câu 24: Cho phương trình hóa học của phản ứng:
Biến thiên enthalpy của phản ứng là
Biết:
|
Chất |
C2H5OH |
C2H4 |
H2O |
|
(kJ/ mol) |
-277,63 |
+52,47 |
-285,84 |
A. + 44,26 kJ. B. - 44,26 kJ.
C. + 22,13 kJ. D. – 22,13 kJ.
Câu 25: Phát biểu nào sau đây không đúng?
A. Phản ứng hoá học là quá trình phá vỡ các liên kết trong chất đầu và hình thành các liên kết mới để tạo thành sản phẩm.
B. Sự phá vỡ liên kết cần cung cấp năng lượng.
C. Sự hình thành liên kết giải phóng năng lượng.
D. Sự hình thành liên kết cần cung cấp năng lượng.
Câu 26: Phản ứng tổng hợp ammonia: N2(g) + 3H2(g) → 2NH3(g).
Biết năng lượng liên kết (kJ/mol) của N ≡ N; N - H và H - H lần lượt là 946; 391 và 436.
Biến thiên enthalpy của phản ứng là
A. + 92 kJ. B. -92 kJ.
C. + 46 kJ. D. -46 kJ.
Câu 27: Điều kiện nào sau đây không phải là điều kiện chuẩn?
A. Áp suất 1 bar và nhiệt độ 25oC hay 298K.
B. Áp suất 1 bar và nhiệt độ 298K.
C. Áp suất 1 bar và nhiệt độ 25oC.
D. Áp suất 1 bar và nhiệt độ 25K.
Câu 28: Phương trình hóa học nào dưới đây biểu thị enthalpy tạo thành chuẩn của CO(g)?
A. 2C(than chì) + O2(g) → 2CO(g).
B. C(than chì) + O(g) → CO(g).
C. C(than chì) + .
D. C(than chì) + CO2(g) → 2CO(g).
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Cân bằng phản ứng sau bằng phương pháp thăng bằng electron và chỉ rõ chất oxi hóa, chất khử.
a) SO2 + H2O + Cl2 → H2SO4 + HCl.
b) Fe(OH)2 + H2SO4 đặc Fe2(SO4)3 + SO2 + H2O.
Câu 2 (1 điểm): Cho phản ứng: N2 (g) + 3H2 (g) → 2NH3 (g)
a) Trong nhà máy sản xuất NH3, ban đầu phải đốt nóng N2 và H2 để phản ứng diễn ra. Nhiệt toả ra từ phản ứng này lại được dùng để đốt nóng N2 và H2 trong các phản ứng tiếp theo. Cách làm này có ý nghĩa gì về mặt kinh tế.
b) Tính enthalpy tạo thành chuẩn của NH3.
Câu 3 (1 điểm): Cho phản ứng: C3H8(g) ⟶ CH4(g) + C2H4(g).
Giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn được cho ở bảng sau:
|
Liên kết |
C – H |
C – C |
C = C |
|
Eb (kJ/mol) |
418 |
346 |
612 |
a) Tính biến thiên enthalpy của phản ứng trên.
b) Cho biết phản ứng là toả nhiệt hay thu nhiệt. Giải thích.
Hướng dẫn giải đề 001
Phần I: Trắc nghiệm
|
1 - D |
2 - B |
3 - D |
4 - A |
5 - A |
6 - B |
7 - C |
8 - B |
9 - D |
10 - D |
|
11 - D |
12 - A |
13 - C |
14 - C |
15 - D |
16 - B |
17 - C |
18 - D |
19 - B |
20 - A |
|
21 - D |
22 - A |
23 - A |
24 - B |
25 - D |
26 - A |
27 - D |
28 - C |
|
|
Câu 3:
Hợp chất NH4NO2 được tạo thành từ các ion: NH4+ và NO2-.
Gọi số oxi hoá của N trong NH4+ là x, ta có: x + (+1) × 4 = + 1 Þ x = -3.
Gọi số oxi hoá của N trong NO2- là y, ta có: y + (-2).2 = - 1 Þ y = +3.
Câu 12:
Cu + 2H2SO4 (đặc) CuSO4 + SO2 + 2H2O
Theo PTHH có:
Vậy V = 0,2 × 24,79 = 4,958 (lít).
Câu 14:
2Na2O2 + 2CO2 → 2Na2CO3 + O2↑
Tổng hệ số cân bằng của chất tham gia là: 2 + 2 = 4.
Câu 24:
Biến thiên enfhalpy của phản ứng tính theo nhiệt tạo thành chuẩn:
= - 277,63 - (+52,47) - (-285,84) = -44,26 kJ.
Câu 26:
= EN≡N + 3EH-H – 6EN-H = 946 + 3.436 – 6.391 = -92 kJ.
Phần II: Tự luận
Câu 1:
a)
Chất oxi hoá: Cl2; chất khử: SO2

Phương trình hóa học:
.
b)
Chất khử: Fe(OH)2.
Chất oxi hóa: H2SO4.
Ta có các quá trình:
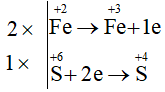
Phương trình hoá học:
2Fe(OH)2 + 4H2SO4 đặc Fe2(SO4)3 + SO2 + 6H2O
Câu 2:
a) Nhiệt toả ra từ phản ứng này lại được dùng để đốt nóng hỗn hợp N2 và H2 trong quá trình phản ứng tiếp theo. Cách làm này giúp tiết kiệm năng lượng do phản ứng xảy ra ở nhiệt độ cao.
b) Enthalpy tạo thành chuẩn của NH3:
Câu 3:
a)
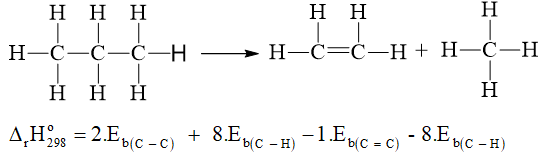
= 2.346 + 8.418 - 1.612 - 8.418 = +80 kJ.
b) Phản ứng là thu nhiệt do
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Giữa Học kì 2
Năm học ...
Môn: Hóa học 10
Thời gian làm bài: 45 phút
Đề thi Giữa Học kì 2 Hóa học lớp 10 Kết nối tri thức có đáp án - (Đề số 2)
|
Sở GD- ĐT … TRƯỜNG THPT …
Mã đề thi: 002
|
ĐỀ KIỂM TRA GIỮA HỌC KÌ II Năm học ... Môn: Hóa học 10 Bộ: Kết nối tri thức với cuộc sống Thời gian làm bài: 45 phút; (28 câu trắc nghiệm – 3 câu tự luận) |
(Học sinh không được sử dụng tài liệu)
Họ, tên học sinh:..................................................................... Lớp: .............................
Đề bài:
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Quy tắc xác định số oxi hoá nào sau đây không đúng?
A. Trong đơn chất, số oxi hoá của nguyên tử bằng 0.
B. Trong phân tử hợp chất, số oxi hoá của oxygen luôn là -2.
C. Trong hợp chất, tổng số oxi hoá của các nguyên tử trong phân tử bằng 0.
D. Trong ion đơn nguyên tử, số oxi hoá của nguyên tử bằng điện tích ion.
Câu 2: Số oxi hóa của aluminium trong Al, Al2O3 lần lượt là
A. 0, +2. B. 0, +3.
C. +3, 0. D. 0, -3.
Câu 3: Số oxi hóa của chromium trong K2Cr2O7 là
A. +1. B. +4.
C. +6. D. +7.
Câu 4: Dấu hiệu để nhận biết một phản ứng oxi hóa – khử là dựa trên sự thay đổi đại lượng nào sau đây của nguyên tử?
A. Khối lượng nguyên tử.
B. Số oxi hóa.
C. Số hiệu nguyên tử.
D. Số khối.
Câu 5: Cho phản ứng: NH3 + HCl → NH4Cl. Trong đó, NH3 đóng vai trò là
A. chất khử.
B. vừa là chất oxi hoá vừa là chất khử.
C. chất oxi hoá.
D. không phải là chất khử, không là chất oxi hoá.
Câu 6: Trong phản ứng nào sau đây HCl đóng vai trò là chất oxi hoá?
A. 2HCl + FeO → FeCl2 + H2O.
B. 2HCl + Na2CO3 → 2NaCl + CO2 + H2O.
C. 16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2 + 8H2O.
D. 2HCl + Mg → MgCl2 + H2.
Câu 7: Chất khử là chất
A. nhường electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
B. nhường electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
C. nhận electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
D. nhận electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
Câu 8: Trong phản ứng hoá học: 2Al + 6HCl → 2AlCl3 + H2, mỗi nguyên tử Al đã
A. nhận 3 electron.
B. nhường 3 electron.
C. nhận 2 electron.
D. nhường 2 electron.
Câu 9: Cho phản ứng: Mg + H2SO4 → MgSO4 + H2S + H2O. Khi hệ số cân bằng phản ứng là nguyên và tối giản thì số phân tử H2O tạo thành là
A. 3. B. 10.
C. 5. D. 4.
Câu 10: Cho từng chất: Fe, FeO, Fe(OH)2, Fe(OH)3, FeSO4, Fe2O3, Fe(NO3)2 lần lượt phản ứng với HNO3 đặc, nóng. Số phản ứng thuộc loại phản ứng oxi hoá - khử là
A. 4. B. 5.
C. 7. D. 6.
Câu 11: Tổng hệ số cân bằng (là các số nguyên, tối giản) của các chất trong phản ứng dưới đây là
Fe3O4 + HNO3 ® Fe(NO3)3 + NO + H2O
A. 55. B. 20.
C. 25. D. 50.
Câu 12: Cho 17,4 gram MnO2 tác dụng với dung dịch HCl đặc, dư theo sơ đồ phản ứng sau: MnO2 + HCl → MnCl2 + Cl2↑ + H2O. Số mol HCl bị oxi hoá là
A. 0,2. B. 0,1.
C. 0,4. D. 0,8.
Câu 13: Một số loại xe ô tô được trang bị một thiết bị an toàn là túi chứa một lượng nhất định hợp chất ion sodium azide (NaN3), được gọi là "túi khí". Khi có va chạm mạnh xảy ra, sodium azide bị phân huỷ rất nhanh, giải phóng khí N2 và nguyên tố Na, làm túi phồng lên, bảo vệ được người trong xe tránh khỏi thương tích. Phương trình hoá học của phản ứng phân huỷ sodium azide là
A. 2NaN3 → 2Na + 3N2.
B. 2NaN3 → 2Na + N2.
C. NaN3 → Na + 3N2.
D. 2NaN3 → Na + 3N2
Câu 14: Trong công nghiệp, sulfuric acid được sản xuất từ quặng pirite sắt có thành phần chính là FeS2, theo sơ đồ sau: FeS2 → SO2 → SO3 → H2SO4.
Khối lượng H2SO4 98% điều chế được từ 1 tấn quặng chứa 60% FeS2 (biết hiệu suất cả quá trình là 80%) là
A. 0,4 tấn. B. 0,6 tấn.
C. 0,8 tấn. D. 1,0 tấn.
Câu 15: Sản xuất gang trong công nghiệp bằng cách sử dụng khí CO khử Fe2O3 ở nhiệt độ cao theo phản ứng sau:
![]()
Trong phản ứng trên chất đóng vai trò chất khử là
A. Fe2O3. B. CO.
C. Fe. D. CO2.
Câu 16: Phản ứng thu nhiệt là
A. phản ứng hấp thụ năng lượng dưới dạng nhiệt.
B. phản ứng giải phóng năng lượng dưới dạng nhiệt.
C. phản ứng cung cấp nhiệt cho môi trường.
D. phản ứng làm nhiệt độ môi trường tăng lên.
Câu 17: Trong các phản ứng sau:
(1) Phản ứng đốt cháy cồn.
(2) Phản ứng tôi vôi.
(3) Phản ứng nhiệt phân thuốc tím.
Phản ứng toả nhiệt là
A. (1). B. (1) và (2).
C. (2) và (3). D. (1), (2) và (3).
Câu 18: Phản ứng thu nhiệt thì
A. ∆rH = 0. B. ∆rH < 0.
C. ∆rH > 0. D. ∆rH ≥ 0.
Câu 19: Biến thiên enthalpy chuẩn của phản ứng là
A. nhiệt lượng toả ra của phản ứng ở điều kiện áp suất không đổi.
B. nhiệt lượng thu vào của phản ứng ở điều kiện áp suất không đổi.
C. nhiệt lượng toả ra hoặc thu vào của phản ứng ở điều kiện áp suất không đổi.
D. nhiệt lượng toả ra hoặc thu vào của phản ứng ở điều kiện chuẩn.
Câu 20: Cho các phản ứng sau:
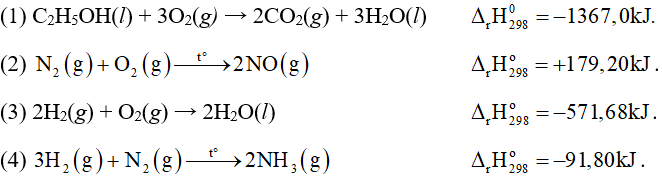
Số phản ứng toả nhiệt là
A. 1. B. 2.
C. 3. D. 4.
Câu 21: Cho hai phương trình nhiệt hóa học sau:
(1)
(2)
Nhận xét đúng là
A. Phản ứng (1) xảy ra thuận lợi hơn.
B. Phản ứng (2) xảy ra thuận lợi hơn.
C. Cả hai phản ứng đều thu nhiệt.
D. Phản ứng (1) toả ra nhiều nhiệt hơn.
Câu 22: Cho phản ứng sau: CaCO3(s) → CaO(s) + CO2(g). Ở điều kiện chuẩn, biến thiên enthalpy của phản ứng là (Biết nhiệt tạo thành (kJ/mol) của CaCO3, CaO và CO2 lần lượt là -1 207, -635 và -393,5)
A. +178,5 kJ. B. -178,5 kJ.
C. + 357 kJ. D. -357 kJ.
Câu 23: Cho phản ứng sau:
Biết nhiệt tạo thành chuẩn của SO2 là -296,8 kJ/mol. Nhiệt tạo thành chuẩn của SO3 là
A. + 441 kJ/mol. B. -441 kJ/mol.
C. + 414 kJ/mol. D. -414 kJ/mol.
Câu 24: Cho các phản ứng sau:
(1) C(s) + CO2(g) → 2CO(g) = 173,6 kJ
(2) C(s) + H2O(g) → CO(g) + H2(g) = 133,8 kJ
(3) CO(g) + H2O(g) → CO2(g) + H2(g)
Ở 500K, 1 atm, biến thiên enthalpy của phản ứng (3) có giá trị là
A. -39,8 kJ. B. 39,8 kJ.
C. -47,00 kJ. D. 106,7 kJ.
Câu 25: Công thức tính biến thiên enthalpy của phản ứng theo năng lượng liên kết là
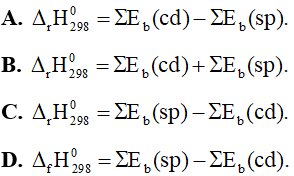
Câu 26: Cho phản ứng sau: CH≡CH(g) + H2(g) → CH3-CH3(g).
Năng lượng liên kết (kJ/mol) của H-H là 436, của C-C là 347, của C-H là 414 và của C≡C là 839. Biến thiên enthalpy của phản ứng là
A. +292 kJ. B. -292 kJ.
C. +192 kJ. D. -192 kJ.
Câu 27: Enthalpy tạo thành chuẩn của một đơn chất bền
A. là biến thiên enthalpy chuẩn của phản ứng giữa nguyên tố đó với hydrogen.
B. là biến thiên enthalpy chuẩn của phản ứng giữa nguyên tố đó với oxygen.
C. được xác định từ nhiệt độ nóng chảy của nguyên tố đó.
D. bằng 0.
Câu 28: Các quá trình sau:
a) Nước hóa rắn.
b) Sự tiêu hóa thức ăn.
c) Quá trình chạy của con người.
d) Khí CH4 đốt ở trong lò.
e) Hòa tan KBr vào nước làm cho nước trở nên lạnh.
g) Sulfuric acid đặc khi thêm vào nước làm cho nước nóng lên.
Số quá trình thu nhiệt là
A. 2. B. 3.
C. 4. D. 5.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Cân bằng phản ứng sau bằng phương pháp thăng bằng electron và chỉ rõ chất oxi hóa, chất khử.
a) Al + HCl AlCl3 + H2.
b) FeS2 + O2 → Fe2O3 + SO2.
Câu 2 (1 điểm): Cho phản ứng đốt cháy ethane:
C2H6 (g) + O2 (g) 2CO2 (g) + 3H2O (l)
Biết:
|
Chất |
C2H6 (g) |
O2 (g) |
CO2 (g) |
H2O (l) |
|
(kJmol-1) |
-84,7 |
0 |
-393,5 |
-285,8 |
a) Tính biến thiên enthalpy chuẩn của phản ứng đốt cháy ethane.
b) Cho biết phản ứng là toả nhiệt hay thu nhiệt, giải thích.
Câu 3 (1 điểm): Cho phản ứng: N2(g) + O2(g) → 2NO(g). Biết năng lượng liên kết trong các phân tử O2, N2 và NO lần lượt là 494 kJ/mol, 945 kJ/mol và 607 kJ/mol. Tính biến thiên enthalpy chuẩn của phản ứng và cho biết vì sao nitrogen chỉ phản ứng với oxygen ở nhiệt độ cao hoặc khi có tia lửa điện.
Hướng dẫn giải đề 002
Phần I: Trắc nghiệm
|
1 - B |
2 - B |
3 - C |
4 - B |
5 - D |
6 - D |
7 - A |
8 - B |
9 - D |
10 - B |
|
11 - A |
12 - C |
13 - A |
14 - C |
15 - B |
16 - A |
17 - B |
18 - C |
19 - D |
20 - C |
|
21 - B |
22 - A |
23 - B |
24 - A |
25 - A |
26 - B |
27 - D |
28 - A |
|
|
Câu 11:
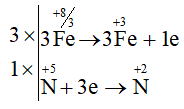
3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O
Tổng hệ số: 3 + 28 + 9 + 1 + 14 = 55.
Câu 12:
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
0,2 → 0,8 mol
Theo phương trình hoá học có cứ 4 mol HCl tham gia phản ứng thì có 2 mol HCl đóng vai trò là chất bị oxi hoá; 2 mol HCl đóng vai trò là chất tạo môi trường.
Þ Vậy cứ 0,8 mol HCl tham gia phản ứng thì có 0,4 mol HCl bị oxi hoá.
Câu 14:
1 tấn quặng chứa 60% FeS2.
Số mol FeS2 trong 1 tấn quặng trên là: 5000 mol
Sơ đồ phản ứng: FeS2 → 2SO2 → 2SO3 → 2H2SO4
Dựa trên sơ đồ có số mol H2SO4 là 2.5000 = 10 000 mol.
Khối lượng H2SO4 thu được là:
98 × 10 000 = 980 000 gam = 980 kg = 0,98 tấn.
Khối lượng H2SO4 98% thu được là: tấn.
Do hiệu suất cả quá trình là 80% nên khối lượng H2SO4 98% thực tế thu được là:
tấn.
Câu 22:
CaCO3(s) → CaO(g) + CO2(g)
= (CaO) + (CO2) - (CaCO3)
= (-635) + (-393,5) – (-1207) = +178,5 (kJ).
Câu 23:
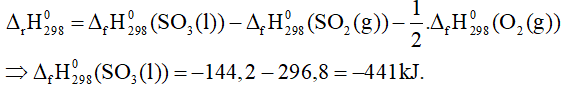
Câu 24:
Lấy phương trình phản ứng (2) trừ phương trình phản ứng (1) được phương trình phản ứng (3).
Þ (3) = (2) - (1)
Þ (3) = 133,8 – 173,6 = - 39,8 (kJ).
Câu 26:
∆rH = 2E(C-H) + E(C≡C) + 2E(H-H) – 6E(C-H) – E(C-C) = (2.414) + 839 + (2.436) – (6.414) – 347 = -292 (kJ).
Phần II: Tự luận
Câu 1:
a)
Chất khử: Al
Chất oxi hóa: HCl
Ta có các quá trình:
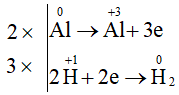
Phương trình hoá học:
2Al + 6HCl → 2AlCl3 + 3H2.
b) ![]()
Chất khử: FeS2; chất oxi hóa: O2
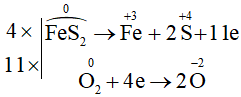
Phương trình hóa học:
Câu 2:

b) Phản ứng là toả nhiệt vì
Câu 3:
N2(g) + O2(g) → 2NO(g)
= (945.1 + 494.1) – 607.2 = 225 (kJ).
> 0, phản ứng thu nhiệt.
Tức là 1 mol N2 (g) phản ứng với 1 mol O2 (g) cần cung cấp 225kJ nhiệt lượng
⇒ Nitrogen chỉ phản ứng với oxygen ở nhiệt độ cao hoặc khi có tia lửa điện.
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Giữa Học kì 2
Năm học ...
Môn: Hóa học 10
Thời gian làm bài: 45 phút
Đề thi Giữa Học kì 2 Hóa học lớp 10 Kết nối tri thức có đáp án - (Đề số 3)
|
Sở GD- ĐT … TRƯỜNG THPT …
Mã đề thi: 001
|
ĐỀ KIỂM TRA GIỮA HỌC KÌ II Năm học ... Môn: Hóa học 10 Bộ: Kết nối tri thức với cuộc sống Thời gian làm bài: 45 phút; (28 câu trắc nghiệm – 3 câu tự luận) |
(Học sinh không được sử dụng tài liệu)
Họ, tên học sinh:..................................................................... Lớp: .............................
Đề bài:
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Trong hợp chất SO3, số oxi hóa của sulfur (lưu huỳnh) là
A. +2 B. +3.
C. +4. D. +6.
Câu 2: Số oxi hóa của chromium (Cr) trong Na2CrO4 là
A. +3. B. +2.
C. +6. D. +7.
Câu 3: Phản ứng oxi hóa – khử là
A. phản ứng hoá học xảy ra đồng thời quá trình nhường electron và quá trình nhận electron.
B. phản ứng hóa học trong đó hai hay nhiều chất ban đầu sinh ra một chất mới.
C. phản ứng hóa học giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất.
D. phản ứng hóa học trong đó một chất sinh ra hai hay nhiều chất mới.
Câu 4: Phát biểu nào sau đây không đúng ?
A. Số oxi hóa là điện tích quy ước của nguyên tử trong phân tử khi coi tất cả các electron liên kết đều chuyển hoàn toàn về nguyên tử có độ âm điện lớn hơn.
B. Trong hợp chất, oxygen có số oxi hóa bằng -2, trừ một số trường hợp ngoại lệ.
C. Số oxi hóa của hydrogen trong các hydride kim loại bằng +1.
D. Các nguyên tố phi kim có số oxi hóa thay đổi tùy thuộc vào hợp chất chứa chúng.
Câu 5: Trong phản ứng oxi hoá – khử, chất nhường electron được gọi là
A. chất khử. B. chất oxi hoá.
C. acid. D. base.
Câu 6: Cho quá trình Al → Al3+ + 3e, đây là quá trình
A. khử.
B. oxi hóa.
C. tự oxi hóa – khử.
D. nhận proton.
Câu 7: Dẫn khí H2 đi qua ống sứ đựng bột CuO nung nóng để thực hiện phản ứng hóa học sau: CuO + H2 Cu + H2O. Trong phản ứng trên, chất đóng vai trò chất oxi hoá là
A. CuO. B. H2.
C. Cu. D. H2O.
Câu 8: Trong phản ứng MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O, vai trò của HCl là
A. chất oxi hóa.
B. chất khử.
C. tạo môi trường.
D. chất khử và môi trường.
Câu 9: Phản ứng nào dưới đây thuộc loại phản ứng oxi hóa - khử?
A. AgNO3 + NaCl → AgCl + NaNO3.
B. NaOH + HCl → NaCl + H2O.
C. FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O.
D. CaO + CO2 → CaCO3.
Câu 10: Cho phương trình hóa học: aFe + bH2SO4 → cFe2(SO4)3 + dSO2 ↑ + eH2O
Tỉ lệ a : b là
A. 1 : 3. B. 1 : 2.
C. 2 : 3. D. 2 : 9.
Câu 11: Để hàn nhanh đường ray tàu hỏa bị hỏng, người ta dùng hỗn hợp tecmit để thực hiện phản ứng nhiệt nhôm: Al + Fe2O3 → Al2O3 + Fe. Phát biểu nào sau đây sai?
A. Al là chất khử.
B. Fe2O3 là chất oxi hóa.
C. Tỉ lệ giữa chất bị khử : chất bị oxi hóa là 2 :1.
D. Sản phẩm khử là Fe.
Câu 12: Cho sơ đồ chuyển hóa nitrogen như sau:
![]()
Có bao nhiêu phản ứng oxi hóa - khử ở sơ đồ trên?
A. 5. B. 4.
C. 3. D. 2.
Câu 13: Cho 2,34 g kim loại M (hóa trị n) tác dụng với dung dịch H2SO4 (đặc, nóng, dư) thu được 3,2227 L SO2 (điều kiện chuẩn). Kim loại M là
A. Al. B. Fe.
C. Cu. D. Mg.
Câu 14: Rượu gạo là một thức uống có cồn lên men được chưng cất từ gạo theo truyền thống. Rượu gạo được làm từ quá trình lên men tinh bột đã được chuyển thành đường. Vi khuẩn là nguồn gốc của các enzyme chuyển đổi tinh bột thành đường. Nhiệt độ phù hợp để lên men rượu khoảng 20 – 25oC. Phản ứng thủy phân và lên men:
(1) (C6H10O5)n + nH2O → nC6H12O6
(2) C6H12O6 → 2C2H5OH + 2CO2
Phản ứng là phản ứng oxi hóa – khử là
A. Phản ứng (1).
B. Phản ứng (2).
C. Cả hai phản ứng (1) và (2).
D. Không có phản ứng nào thoả mãn.
Câu 15: Trong quá trình Ostwald dùng để sản xuất nitric acid từ ammonia, được đề xuất vào năm 1902. Ở giai đoạn đầu của quá trình xảy ra phản ứng sau:
4NH3 + 5O2 4NO + 6H2O
Chất khử là
A. NH3. B. O2.
C. NO. D. H2O.
Câu 16: Trong không khí ẩm, các vật dụng bằng thép bị oxi hoá tạo ra gỉ sắt:
4Fe + 3O2 + xH2O → 2Fe2O3.xH2O
Phản ứng trên thuộc loại
A. Phản ứng oxi hoá – khử.
B. Phản ứng trao đổi.
C. Phản ứng thế.
D. Phản ứng nhiệt phân.
Câu 17: Phản ứng nào sau đây là phản ứng tỏa nhiệt?
A. Phản ứng phân huỷ đá vôi.
B. Phản ứng nhiệt phân thuốc tím.
C. Phản ứng oxi hóa glucose trong cơ thể.
D. Phản ứng hòa tan NH4Cl trong nước.
Câu 18: Phát biểu nào sau đây là không đúng?
A. Biến thiên enthalpy càng âm, phản ứng tỏa ra càng nhiều nhiệt.
B. Biến thiên enthalpy càng dương, phản ứng thu vào càng nhiều nhiệt.
C. Sự đốt cháy các loại nhiên liệu như xăng, dầu … xảy ra nhanh và toả nhiều nhiệt.
D. Các phản ứng xảy ra ở nhiệt độ phòng thường là phản ứng thu nhiệt.
Câu 19: Phương trình nhiệt hóa học là
A. phương trình phản ứng hóa học xảy ra trong điều kiện cung cấp nhiệt độ.
B. phương trình phản ứng hóa học có kèm theo nhiệt phản ứng.
C. phương trình phản ứng hóa học có kèm theo nhiệt phản ứng và trạng thái của các chất đầu và sản phẩm.
D. phương trình phản ứng hóa học tỏa nhiệt ra môi trường.
Câu 20: Cho phương trình nhiệt hóa học của phản ứng:
2H2(g) + O2(g) → 2H2O(l)
Phản ứng trên là phản ứng
A. không có sự thay đổi năng lượng.
B. có sự hấp thụ nhiệt lượng từ môi trường xung quanh.
C. thu nhiệt.
D. tỏa nhiệt.
Câu 21: Cho các phản ứng sau:

Trong các phản ứng trên, phản ứng nào tỏa nhiều nhiệt nhất?
A. (1). B. (2).
C. (3). D. (4).
Câu 22: Khi nung vôi, người ta phải xếp đá vôi lẫn với than trong lò vì
A. phản ứng nung vôi là phản ứng tỏa nhiệt.
B. phản ứng nung vôi là phản ứng thu nhiệt, cần nhiệt từ quá trình đốt cháy than.
C. thời gian nung vôi dài.
D. than hấp thu bớt lượng nhiệt tỏa ra của phản ứng nung vôi.
Câu 23. Điều kiện chuẩn là điều kiện ứng với
A. áp suất 1 bar (đối với chất khí), nồng độ 1 mol/L (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298K (25oC).
B. áp suất 1 atm (đối với chất khí), nồng độ 1 mol/L (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298K (25oC).
C. áp suất 1 bar (đối với chất khí), nồng độ 2 mol/L (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298K (25oC).
D. áp suất 2 atm (đối với chất khí), nồng độ 2 mol/L (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298K (25oC).
Câu 24: Cho phản ứng tổng quát: aA + bB → mM + nN. Cho các phương án tính của phản ứng:

Số phương án tính của phản ứng đúng là
A. 1. B. 2.
C. 3. D. 4.
Câu 25: Enthalpy tạo thành chuẩn của các đơn chất bền bằng
A. +1 kJ/ mol.
B. -1 kJ/ mol.
C. +2 kJ/ mol.
D. 0 kJ/ mol.
Câu 26: Cho các phát biểu sau:
(a) Biến thiên enthalpy chuẩn của một phản ứng hóa học là lượng nhiệt kèm theo phản ứng đó ở áp suất 1 atm và 25 oC.
(b) Nhiệt (tỏa ra hay thu vào) kèm theo một phản ứng được thực hiện ở 1 bar và 298 K là biến thiên enthalpy chuẩn của phản ứng đó.
(c) Một số phản ứng khi xảy ra làm môi trường xung quanh lạnh đi là do các phản ứng này thu nhiệt và lấy nhiệt từ môi trường.
(d) Một số phản ứng khi xảy ra làm môi trường xung quanh nóng lên là phản ứng thu nhiệt.
Số phát biểu không đúng là
A. 2. B. 3.
C. 4. D. 1.
Câu 27: Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:
|
Liên kết |
C–H |
C–C |
C=C |
|
Eb (kJ/mol) |
418 |
346 |
612 |
Biến thiên enthalpy của phản ứng: C3H8(g) → CH4(g) + C2H4(g) có giá trị là
A. +103 kJ. B. –103 kJ.
C. +80 kJ. D. –80 kJ.
Câu 28: Cho biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn:
CO(g) + O2(g) → CO2(g)
Biết nhiệt tạo thành chuẩn của CO2: (CO2(g)) = –393,5 kJ/mol. Nhiệt tạo thành chuẩn của CO là
A. –110,5 kJ. B. +110,5 kJ.
C. –141,5 kJ. D. –221,0 kJ.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Cân bằng các phản ứng sau bằng phương pháp thăng bằng electron, nêu rõ chất oxi hóa, chất khử, quá trình oxi hoá, quá trình khử:
a) H2S + SO2 → S + H2O
b) KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
Câu 2 (1 điểm): Ở điều kiện chuẩn, 1 mol nhôm tác dụng vừa đủ với khí chlorine tạo ra muối aluminium chloride và giải phóng một lượng nhiệt 695,405 kJ.
a) Viết phương trình hoá học của phản ứng và cho biết phản ứng này có là phản ứng oxi hóa – khử không? Vì sao?
b) Biến thiên enthalpy chuẩn của phản ứng bằng bao nhiêu? Phản ứng thu nhiệt hay tỏa nhiệt?
Câu 3 (1 điểm): Phản ứng tạo thành propene từ propyne:
![]()
a) Hãy xác định số liên kết C – H; C – C; C ≡ C trong hợp chất CH3 – C ≡ CH (propyne).
b) Cho năng lượng của các liên kết:
|
Liên kết |
C – H |
C – C |
C = C |
C ≡ C |
H - H |
|
Eb (kJ/mol) |
413 |
347 |
614 |
839 |
432 |
Hãy tính biến thiên enthalpy của phản ứng tạo thành propene trên.
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Giữa Học kì 2
Năm học ...
Môn: Hóa học 10
Thời gian làm bài: 45 phút
Đề thi Giữa Học kì 2 Hóa học lớp 10 Kết nối tri thức có đáp án - (Đề số 4)
Sở GD- ĐT … TRƯỜNG THPT …
Mã đề thi: 002
|
ĐỀ KIỂM TRA GIỮA HỌC KÌ II Năm học ... Môn: Hóa học 10 Bộ: Kết nối tri thức với cuộc sống Thời gian làm bài: 45 phút; (28 câu trắc nghiệm – 3 câu tự luận) |
(Học sinh không được sử dụng tài liệu)
Họ, tên học sinh:..................................................................... Lớp: .............................
Đề bài:
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Phản ứng oxi hóa – khử là
A. phản ứng hóa học trong đó một chất sinh ra hai hay nhiều chất mới.
B. phản ứng hoá học xảy ra đồng thời quá trình nhường electron và quá trình nhận electron.
C. phản ứng hóa học trong đó có sự thay đổi số oxi hóa của ít nhất hai nguyên tố hóa học.
D. phản ứng hóa học trong đó hai hay nhiều chất ban đầu sinh ra một chất mới.
Câu 2: Số oxi hóa của magnesium trong MgO là
A. 0. B. +1.
C. +2. D. -2.
Câu 3: Số oxi hóa của phosphorus trong PO43- là
A. +1. B. +3.
C. +5. D. +8.
Câu 4: Cho phương trình hóa học của phản ứng: Cl2 + 2KOH ® KCl + KClO + H2O. Trong phản ứng trên, Cl2 đóng vai trò là
A. là chất oxi hóa.
B. là chất khử.
C. không là chất oxi hóa, không là chất khử
D. vừa là chất oxi hóa, vừa là chất khử.
Câu 5: Cho các hợp chất sau: NH3, NH4HCO3, HNO3, NO2. Số hợp chất chứa nguyên tử nitrogen có số oxi hoá -3 là
A. 1. B. 3.
C. 2. D. 4.
Câu 6: Trong phản ứng oxi hóa – khử
A. chất bị oxi hóa nhận electron và chất bị khử nhường electron.
B. quá trình oxi hóa và quá trình khử luôn xảy ra đồng thời.
C. chất chứa nguyên tố có số oxi hóa cực đại luôn là chất khử.
D. quá trình nhận electron gọi là quá trình oxi hóa.
Câu 7: Phản ứng nào dưới đây không phải phản ứng oxi hoá - khử?
A.
B.
C. Cl2 + 2NaOH → NaCl + NaClO + H2O.
D. 4Fe(OH)2 + O2 2Fe2O3 + 4H2O.
Câu 8: Cho phản ứng hóa học: Fe + CuSO4 → FeSO4 + Cu. Trong phản ứng này xảy ra
A. sự khử Fe2+ và sự oxi hóa Cu.
B. sự khử Fe2+ và sự khử Cu2+.
C. sự oxi hóa Fe và sự oxi hóa Cu.
D. sự oxi hóa Fe và sự khử Cu2+.
Câu 9: Cho quá trình , đây là quá trình
A. khử.
B. oxi hóa.
C. tự oxi hóa – khử.
D. nhận proton
Câu 10: Trong phản ứng hoá học: Mg + H2SO4 → MgSO4 + H2, mỗi nguyên tử Mg đã
A. nhường 2 electron.
B. nhận 2 electron.
C. nhường 1 electron.
D. nhận 1 electron.
Câu 11: Cho phản ứng:
aFe + bHNO3 → cFe(NO3)3 + dNO + eH2O
Các hệ số a, b, c, d, e là những số nguyên, đơn giản nhất. Tổng (a + b) bằng
A. 4. B. 3.
C. 6. D. 5.
Câu 12: Tổng hệ số cân bằng (là những số nguyên, tối giản) của các chất trong phản ứng dưới đây là
Fe3O4 + H2SO4 ® Fe2(SO4)3 + SO2 + H2O
A. 21. B. 26.
C. 19. D. 28.
Câu 13: Trong phản ứng: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O. Số phân tử nitric acid (HNO3) đóng vai trò chất oxi hóa là
A. 8. B. 6.
C. 4. D. 2.
Câu 14: Cho phản ứng hóa học: Cl2 + KOH KCl + KClO3 + H2O
Tỉ lệ giữa số nguyên tử chlorine đóng vai trò chất oxi hóa và số nguyên tử chlorine đóng vai trò chất khử trong phương trình hóa học của phản ứng đã cho tương ứng là
A. 1 : 5. B. 5 : 1.
C. 3 : 1. D. 1 : 3.
Câu 15: Trong quá trình bảo quản, một mẫu iron(II) sulfate bị oxi hoá một phần thành hợp chất iron (III). Hàm lượng iron (II) sulfate còn lại trong mẫu được xác định thông qua phản ứng với thuốc tím có nồng độ đã biết theo phản ứng:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Vai trò của H2SO4 trong phản ứng là
A. chất khử.
B. chất oxi hoá.
C. chất tạo môi trường.
D. chất oxi hoá và chất tạo môi trường.
Câu 16: Phát biểu nào sau đây không đúng?
A. Phản ứng hấp thu năng lượng dưới dạng nhiệt gọi là phản ứng thu nhiệt.
B. Các phản ứng hóa học khi xảy ra luôn kèm theo sự giải phóng hoặc hấp thu năng lượng.
C. Với cùng một phản ứng, ở điều kiện khác nhau về nhiệt độ, áp suất thì lượng nhiệt kèm theo như nhau.
D. Phản ứng nung vôi là phản ứng thu nhiệt.
Câu 17: Enthalpy tạo thành của một chất (∆fH) là biến thiên enthalpy của phản ứng tạo thành
A. 1 gam chất đó từ các đơn chất bền nhất, ở điều kiện chuẩn.
B. 1 lít chất đó từ các đơn chất dạng bền nhất, ở điều kiện chuẩn.
C. 1 mol chất đó từ các đơn chất bền nhất, ở một điều kiện xác định.
D. 1 mol chất đó từ các hợp chất bền nhất, ở một điều kiện xác định.
Câu 18: Cho các quá trình sau:
(1) Luyện gang từ quặng hematite đỏ.
(2) Luyện zinc từ quặng blend.
(3) Đốt cháy ethanol trong xăng E5.
(4) Đưa mẩu than gỗ nóng đỏ vào bình chứa khí oxygen.
Số quá trình có phản ứng oxi hoá – khử xảy ra là
A. 1. B. 2.
C. 3. D. 4.
Câu 19: Cho phản ứng đốt cháy quặng pyrite để sản xuất sulfuric acid như sau:
4FeS2 + 11O2 2Fe2O3 + 8H2O
Phản ứng này thuộc loại
A. Phản ứng oxi hoá – khử.
B. Phản ứng trao đổi.
C. Phản ứng thế.
D. Phản ứng phân huỷ.
Câu 20: Phát biểu nào sau đây không đúng?
A. Các phản ứng phân hủy thường là phản ứng thu nhiệt.
B. Phản ứng càng tỏa ra nhiều nhiệt càng dễ tự xảy ra.
C. Phản ứng oxi hóa chất béo cung cấp nhiệt cho cơ thể.
D. Các phản ứng khi đun nóng đều dễ xảy ra hơn.
Câu 21: Phản ứng giải phóng năng lượng dưới dạng nhiệt gọi là
A. phản ứng thu nhiệt.
B. phản ứng tỏa nhiệt.
C. phản ứng oxi hóa – khử.
D. phản ứng phân hủy.
Câu 22: Phản ứng chuyển hóa giữa hai dạng đơn chất của phosphorus (P):
P(s, đỏ) → P(s, trắng) = 17,6 kJ
Điều này chứng tỏ phản ứng
A. tỏa nhiệt, P đỏ bền hơn P trắng.
B. tỏa nhiệt, P trắng bền hơn P đỏ.
C. thu nhiệt, P đỏ bền hơn P trắng.
D. thu nhiệt, P trắng bền hơn P đỏ.
Câu 23: Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau:
N2(g) + O2(g) → 2NO(g) = +180 kJ
Kết luận nào sau đây đúng?
A. Phản ứng xảy ra thuận lợi ở điều kiện thường.
B. Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường.
C. Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp.
D. Phản ứng tỏa nhiệt.
Câu 24: Ở điều kiện chuẩn, cần phải cung cấp 52,96 kJ nhiệt lượng cho quá trình 1 mol H2(g) phản ứng với 1 mol I2(s) để thu được 2 mol HI(g). Như vậy, enthalpy tạo thành của hydrogen iodide (HI) là
A. 26,48 kJ/ mol.
B. –26,48 kJ/ mol.
C. 52,96 kJ/ mol.
D. –52,96 kJ/ mol.
Câu 25: Các phản ứng tỏa nhiệt thường diễn ra
A. thuận lợi hơn các phản ứng thu nhiệt.
B. khó khăn hơn các phản ứng thu nhiệt.
C. thuận lợi hơn khi càng tỏa nhiều nhiệt.
D. thuận lợi hơn khi càng tỏa ít nhiệt.
Câu 26: Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:
|
Liên kết |
C–H |
C–C |
C=C |
|
Eb (kJ/mol) |
418 |
346 |
612 |
Biến thiên enthalpy của phản ứng: C3H8(g) → CH4(g) + C2H4(g) có giá trị là
A. +103 kJ. B. –103 kJ.
C. +80 kJ. D. –80 kJ.
Câu 27: Cho các phản ứng sau:
(1) C(s) + CO2(g) → 2CO(g)
(2) C(s) + H2O(g) → CO(g) + H2(g)
(3) CO(g) + H2O(g) → CO2(g) + H2(g)
Ở 500 K, 1 atm, biến thiên enthalpy của phản ứng (3) có giá trị là
A. –39,8 kJ. B. 39,8 kJ.
C. –47,00 kJ. D. 106,7 kJ.
Câu 28: Tiến hành ozone hóa 100 gam oxygen theo phản ứng sau:
3O2(g) → 2O3(g)
Hỗn hợp thu được có chứa 24% ozone về khối lượng, tiêu tốn 71,2 kJ. Nhiệt tạo thành của ozone (kJ/mol) có giá trị là
A. 142,4. B. 284,8.
C. –142,4. D. –284,8.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Cân bằng các phản ứng sau bằng phương pháp thăng bằng electron, nêu rõ chất oxi hóa, chất khử, quá trình oxi hoá, quá trình khử:
a) MnO2 + HCl → MnCl2 + Cl2 + H2O
b) Mg + HNO3 → Mg(NO3)2 + NH4NO3 + H2O
Câu 2 (1 điểm): Phản ứng nhiệt nhôm là phản ứng dùng nhôm để khử các oxide kim loại ở nhiệt độ cao. Ứng dụng phổ biến của phản ứng là hàn đường ray xe lửa:
2Al (s) + Fe2O3 (s) Al2O3 (s) + 2Fe (s)
Biết của Fe2O3 (s) là –824,2 kJ/ mol, của Al2O3 (s) là –1675,7 kJ/ mol. Giải thích vì sao phản ứng nhiệt nhôm là phản ứng tỏa nhiệt.
Câu 3 (1 điểm): Ammonia thường được tổng hợp từ nitrogen và hydrogen bằng quy trình Haber – Bosch:
N2 (g) + 3H2 (g) ⇄ 2NH3 (g)
a) Tính giá trị của phản ứng trên từ các giá trị năng lượng liên kết sau:
|
Liên kết |
N ≡ N |
H - H |
N – H |
|
Eb (kJ/mol) |
945 |
436 |
391 |
b) Tính nhiệt tạo thành tiêu chuẩn của NH3 (g).
Để xem trọn bộ Đề thi Hóa học 10 Kết nối tri thức có đáp án, Thầy/ cô vui lòng Tải xuống!
Xem thêm đề thi các môn lớp 10 bộ Kết nối tri thức hay, có đáp án chi tiết:
Đề thi Giữa học kì 2 Văn lớp 10 Kết nối tri thức (10 đề có đáp án + ma trận)
Đề thi Giữa học kì 2 Toán lớp 10 Kết nối tri thức (10 đề có đáp án + ma trận)
Đề thi Giữa học kì 2 Tiếng Anh lớp 10 Global Success (10 đề có đáp án + ma trận) | Kết nối tri thức
Đề thi Giữa học kì 2 Tin học lớp 10 Kết nối tri thức (10 đề có đáp án + ma trận)
Đề thi Giữa học kì 2 Vật lí lớp 10 Kết nối tri thức (10 đề có đáp án + ma trận)
Đề thi Giữa học kì 2 Sinh học lớp 10 Kết nối tri thức (10 đề có đáp án + ma trận)
Đề thi Giữa học kì 2 Lịch sử lớp 10 Kết nối tri thức (10 đề có đáp án + ma trận)
Đề thi Giữa học kì 2 Địa lí lớp 10 Kết nối tri thức (10 đề có đáp án + ma trận)
Đề thi Giữa học kì 2 Công Nghệ Trồng Trọt lớp 10 Kết nối tri thức (10 đề có đáp án + ma trận)
Đề thi Giữa học kì 2 Công Nghệ Thiết kế lớp 10 Kết nối tri thức (10 đề có đáp án + ma trận)
Xem thêm các chương trình khác:
- TOP 100 Đề thi Toán 10 (cả năm) (Chân trời sáng tạo) 2024 - 2025 có đáp án
- TOP 100 Đề thi Tiếng Anh 10 (cả năm) Friends Global 2024 - 2025 có đáp án
- TOP 100 Đề thi Ngữ Văn 10 (cả năm) (Chân trời sáng tạo) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Hóa học 10 (cả năm) (Chân trời sáng tạo) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Vật lí 10 (cả năm) (Chân trời sáng tạo năm) 2024 - 2025 có đáp án
- TOP 100 Đề thi Sinh học 10 (cả năm) (Chân trời sáng tạo năm) 2024 - 2025 có đáp án
- TOP 100 Đề thi Lịch sử 10 (cả năm) (Chân trời sáng tạo năm) 2024 - 2025 có đáp án
- TOP 100 Đề thi Địa lí 10 (cả năm) (Chân trời sáng tạo năm) 2024 - 2025 có đáp án
- TOP 100 Đề thi Kinh tế pháp luật 10 (cả năm) (Chân trời sáng tạo) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Toán 10 (cả năm) (Cánh diều) 2024 - 2025 có đáp án
- TOP 100 Đề thi Tiếng Anh 10 (cả năm) Explore new worlds năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Ngữ Văn 10 (cả năm) (Cánh diều) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Hóa học 10 (cả năm) (Cánh diều) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Vật lí 10 (cả năm) (Cánh diều) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Sinh học 10 (cả năm) (Cánh Diều) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Lịch sử 10 (cả năm) (Cánh diều) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Địa lí 10 (cả năm) (Cánh Diều) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Công nghệ 10 (Cả năm) (Cánh Diều) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Kinh tế pháp luật 10 (cả năm) (Cánh Diều) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Tin học 10 (cả năm) (Cánh Diều) 2024 - 2025 có đáp án
- TOP 100 Đề thi Tiếng Anh 10 (cả năm) iLearn Smart World năm 2024 - 2025 có đáp án
