Đề cương ôn tập Hóa học 10 Giữa học kì 1 (Kết nối tri thức 2024)
Vietjack.me biên soạn và giới thiệu Đề cương ôn tập Hóa học 10 Giữa học kì 1 sách Kết nối tri thức giúp bạn ôn luyện và đạt kết quả cao trong bài thi Hóa học 10 Giữa kì 1.
Đề cương ôn tập Hóa học 10 Giữa học kì 1 (Kết nối tri thức 2024)
A. TÓM TẮT LÝ THUYẾT
1. Thành phần nguyên tử
Nguyên tử là hạt trung hòa về điện, có cấu tạo 2 phần:
+ Nhân nguyên tử: proton (p) mang điện dương, neutron (n) không mang điện.
+ Vỏ nguyên tử: các electron (e) mang điện âm.
Khối lượng nguyên tử coi như bằng khối lượng hạt nhân (khối lượng các hạt proton và neutron).
|
Cấu tạo nguyên tử |
Vỏ nguyên tử |
Hạt nhân |
|
|
Electron |
Proton |
Neutron |
|
|
Điện tích |
1- |
1+ |
0 |
|
Khối lượng (amu) |
0,00055 |
1 |
1 |
Số Avorgaro: Số nguyên tử hay phân tử có trong 1 mol chất luôn bằng6,023.1023.
Đơn vị đo khối lượng nguyên tử: 1amu = 1 khối lượng Cacbon ≈1,6605.10-27
2. Hạt nhân nguyên tử
Ký hiệu Z cho biết:
+ Số proton trong hạt nhân.
+ Số electron trong lớp vỏ.
+ Điện tích hạt nhân là: Z+.
+ Số đơn vị điện tích hạt nhân: Z.
+ Số hiệu nguyên tử.
Số khối: A = Z +N
B. ÔN TẬP TỰ LUẬN
Bài 1: Cho các nguyên tử có kí hiệu sau:
![]()
a. Có bao nhiêu nguyên tố hóa học?
b. Những nguyên tử nào là đồng vị của nhau?
c. Những nguyên tử nào cùng số khối?
d. Những nguyên tử nào cùng số neutron?
e. Viết cấu hình e của các nguyên tử trên?
f. Các nguyên tử trên là kim loại, phi kim hay khí hiếm?
g. Xác định số e độc thân trong mỗi nguyên tử trên?
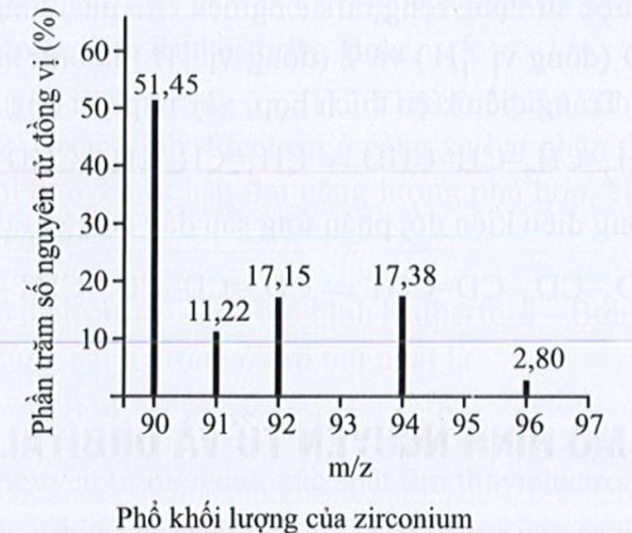
Bài 2: Phổ khối lượng của zirconium (Zr) được biểu diễn như hình sau đây (điện tích z của các đồng vị Zr đều bằng 1+). Hãy xác định số lượng đồng vị bền và tính nguyên tử khối trung bình của Zr?
Bài 3: Trong thể dục thể thao, có một số vận động viên sử dụng các loại chất kích thích trong thi đấu – gọi là doping, dẫn đến thành tích đạt được của họ không thật so với năng lực vốn có. Một trong các loại doping thường gặp là testosterone tổng hợp.
Tỉ lệ giữa 2 đồng vị C-12 (98,89 %) và C-13 (1,11%) là không đổi đối với testossterone tự nhiên trong cơ thể. Trong khi testosterone tổng hợp có phần trăm C-13 ít hơn testossterone tự nhiên. Đây chính là mấu chốt của xét nghiệm CIR – (carbon isotope ratio – tỉ lệ đồng vị carbon) – một xét nghiệm với mục đích xác định xem vận động viên có sử dụng doping hay không.
Giả sử thực hiện phân tích CIR với một vận động viện thu được kết quả % số nguyên tử C-12 là x, C-13 là
Từ tỉ lệ này tính được NTK trung bình của carbon trong mẫu phân tích là 12,0098. Với kết quả thu được em có nghi ngờ vận động viên này sử dụng doping không? Vì sao?
Bài 4: Trong tự nhiên, copper (đồng) có 2 đồng vị 63Cu và ACu, trong đó đồng vị 65Cu chiếm 27% về số nguyên tử. Nguyên tử khối trung bình của copper là 63,54.
Tính A?
Tính phần trăm khối lượng của 63Cu trong kim loại đồng tựnhiên?
Tính phần trăm khối lượng của 63Cu trong CuSO4 (cho O = 16, S =32)?
Bài 5: Một nguyên tố X chủ yếu gồm hai đồng vị bền là X1 và X2. Đồng vị X1 có tổng số hạt là 18. Đồng vị X2 có số hạt mang điện nhiều hơn số hạt không mang điện là 5. Nguyên tử khối trung bình của X là 12,011. Xác định phần trăm số nguyên tử của các đồng vị X1, X2?
Bài 6*: Hợp chất có công thức phân tử M2X được ứng dụng trong sản xuất xi măng, phân bón, hàm lượng % khối lượng M2X được dùng để đánh giá độ dinh dưỡng của phân lân…. Biết phân tử M2X có tổng số hạt là 140, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 44. Số khối của nguyên tử M nhiều hơn số khối của nguyên tử X là 23. Tổng số hạt trong nguyên tử M nhiều hơn trong nguyên tử X là 34. Hãy viết cấu hình e của nguyên tử M, X, ion M+, X2-. Xác định tính chất KL hay PK và số e độc thân trên từng nguyên tử M, X?
C. ÔN TRẮC NGHIỆM
Câu 1: Số electron lớp ngoài cùng có trong nguyên tử silicon (Z = 14) là
1. 5 B. 2 C. 1 D. 4
Câu 2: Số elctron tối đa trong lớp M là
2 B. 32 C. 8 D. 18
Câu 3: Một nguyên tử có cấu hình 1s22s22p3. Chọn phát biểu sai:
1. Nguyên tử đó có 7 electron.
2. Nguyên tử đó có 7 neutron.
3. Không xác định được số neutron.
4. Nguyên tử đó có 7 proton
Câu 4. Phát biểu nào sau đây sai?
1. Số proton trong hạt nhân bằng số electron ở lớp vỏ nguyên tử
2. Chỉ có hạt nhân nguyên tử magnesium mới có 12 proton
3. Khối lượng nguyên tử tập trung chủ yếu ở lớp vỏ nguyên tử
4. Trong nguyên tử mức năng lượng 4s thấp hơn mức năng lượng 3d
Câu 5: Nguyên tố có độ âm điện lớn nhất
A. Fluorine B. Iodine
C. Lithium D. Caesium
Câu 6: Kí hiệu phân lớp nào sau đây là sai?
A. 2p B. 3d C. 4f D. 2d
Câu 7: Các nguyên tố thuộc cùng một nhóm A trong bảng tuần hoàn sẽ có cùng số
A. electron lớp ngoài cùng.
B. điện tích hạt nhân.
C. lớp electron.
D. electron s hay p.
Câu 8: Cho các nguyên tử Al, Na, K, Mg. Thứ tự tăng dần tính kim loại của các nguyên tử trên là
A. Al < Mg < Na < K
B. Al < Na < Mg < K
C. K < Na < Mg < Al
D. K < Mg < Na < Al
Câu 10: Hạt mang điện trong nhân nguyên tử là
A. neutron.
B. electron.
C. proton.
D. neutron và electron.
Câu 11: Nguyên tố hóa học là những nguyên tử có cùng
A. số khối.
B. số nơtron.
C. điện tích hạt nhân.
D. số nơtron và proton.
Xem thêm các chương trình khác:
- TOP 100 Đề thi Toán 10 (cả năm) (Chân trời sáng tạo) 2024 - 2025 có đáp án
- TOP 100 Đề thi Tiếng Anh 10 (cả năm) Friends Global 2024 - 2025 có đáp án
- TOP 100 Đề thi Ngữ Văn 10 (cả năm) (Chân trời sáng tạo) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Hóa học 10 (cả năm) (Chân trời sáng tạo) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Vật lí 10 (cả năm) (Chân trời sáng tạo năm) 2024 - 2025 có đáp án
- TOP 100 Đề thi Sinh học 10 (cả năm) (Chân trời sáng tạo năm) 2024 - 2025 có đáp án
- TOP 100 Đề thi Lịch sử 10 (cả năm) (Chân trời sáng tạo năm) 2024 - 2025 có đáp án
- TOP 100 Đề thi Địa lí 10 (cả năm) (Chân trời sáng tạo năm) 2024 - 2025 có đáp án
- TOP 100 Đề thi Kinh tế pháp luật 10 (cả năm) (Chân trời sáng tạo) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Toán 10 (cả năm) (Cánh diều) 2024 - 2025 có đáp án
- TOP 100 Đề thi Tiếng Anh 10 (cả năm) Explore new worlds năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Ngữ Văn 10 (cả năm) (Cánh diều) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Hóa học 10 (cả năm) (Cánh diều) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Vật lí 10 (cả năm) (Cánh diều) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Sinh học 10 (cả năm) (Cánh Diều) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Lịch sử 10 (cả năm) (Cánh diều) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Địa lí 10 (cả năm) (Cánh Diều) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Công nghệ 10 (Cả năm) (Cánh Diều) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Kinh tế pháp luật 10 (cả năm) (Cánh Diều) năm 2024 - 2025 có đáp án
- TOP 100 Đề thi Tin học 10 (cả năm) (Cánh Diều) 2024 - 2025 có đáp án
- TOP 100 Đề thi Tiếng Anh 10 (cả năm) iLearn Smart World năm 2024 - 2025 có đáp án
