TOP 10 câu Trắc nghiệm Khoa học tự nhiên 7 Bài 5 (Cánh diều 2024) có đáp án: Giới thiệu về liên kết hóa học
Bộ 10 bài tập trắc nghiệm Khoa học tự nhiên lớp 7 Bài 5: Giới thiệu về liên kết hóa học có đáp án đầy đủ các mức độ sách Cánh diều giúp học sinh ôn luyện trắc nghiệm Khoa học tự nhiên lớp 7 Bài 5.
Chỉ 150k mua trọn bộ Trắc nghiệm Khoa học tự nhiên lớp 7 Cánh diều bản word (cả năm) có đáp án chi tiết:
B1: Gửi phí vào tài khoản 033000255833 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận giáo án.
Xem thử tài liệu tại đây: Link tài liệu
Trắc nghiệm Khoa học tự nhiên Bài 5: Giới thiệu về liên kết hóa học - Cánh diều
Câu 1. Số electron lớp vỏ ngoài cùng của các nguyên tử khí hiếm là
A. 1 electron;
B. 2 electron;
C. 8 electron (riêng He có 2 electron);
D. 6 electron (riêng He có 2 electron).
Đáp án: C
Giải thích:
Số electron ở lớp vỏ ngoài cùng của các nguyên tử khí hiếm là 8 electron (riêng He có 2 electron). Đây là lớp vỏ bền vững.
Câu 2. Nguyên tử nào sau đây tồn tại độc lập ở điều kiện thường
A. nguyên tử phi kim;
B. nguyên tử kim loại;
C. nguyên tử oxygen;
D. nguyên tử khí hiếm.
Đáp án: D
Giải thích:
Nguyên tử tồn tại độc lập ở điều kiện thường là nguyên tử khí hiếm do có lớp vỏ electron bền vững.
Câu 3. Sự hình thành liên kết trong phân tử sodium chloride diễn ra như sau
A. Nguyên tử Na cho đi 1 electron ở lớp ngoài cùng để trở thành ion mang điện tích dương (Na+), nguyên tử Cl nhận 1 electron từ nguyên tử Na để trở thành ion mang điện tích âm (Cl−), các ion Na+ và Cl− hút nhau tạo thành liên kết trong phân tử sodium chloride;
B. Nguyên tử Cl cho đi 1 electron ở lớp ngoài cùng để trở thành ion mang điện tích dương (Cl+), nguyên tử Na nhận 1 electron từ nguyên tử Cl để trở thành ion mang điện tích âm (Na−), các ion Cl+ và Na− hút nhau tạo thành liên kết trong phân tử sodium chloride;
C. Nguyên tử Cl cho đi 1 electron ở lớp ngoài cùng để trở thành ion mang điện tích dương (Cl−), nguyên tử Na nhận 1 electron từ nguyên tử Cl để trở thành ion mang điện tích âm (Na+), các ion Cl− và Na+ hút nhau tạo thành liên kết trong phân tử sodium chloride;
D. Nguyên tử Na cho đi 1 electron ở lớp ngoài cùng để trở thành ion mang điện tích âm (Na−), nguyên tử Cl nhận 1 electron từ nguyên tử Na để trở thành ion mang điện tích dương (Cl+), các ion Na− và Cl+ hút nhau tạo thành liên kết trong phân tử sodium chloride.
Đáp án: A
Giải thích:
Sự hình thành liên kết trong phân tử sodium chloride diễn ra như sau
Nguyên tử Na cho đi 1 electron ở lớp ngoài cùng để trở thành ion mang điện tích dương (Na+), nguyên tử Cl nhận 1 electron từ nguyên tử Na để trở thành ion mang điện tích âm (Cl−), các ion Na+ và Cl− hút nhau tạo thành liên kết trong phân tử sodium chloride.
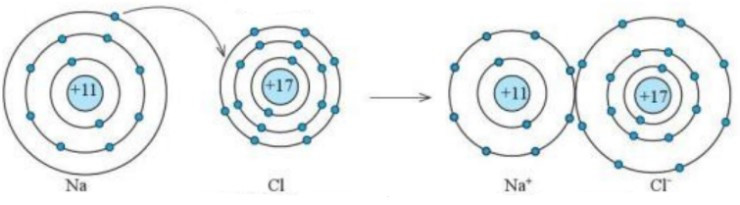
Câu 4. Liên kết được tạo thành bởi lực hút giữa ion dương và ion âm là
A. liên kết cộng hóa trị;
B. liên kết ion;
C. liên kết hydrogen;
D. liên kết đơn.
Đáp án: B
Giải thích:
Liên kết được tạo thành bởi lực hút giữa ion dương và ion âm là liên kết ion.
Câu 5. Ion S2− có lớp vỏ electron tương tự nguyên tử nguyên tố khí hiếm nào?
A. Helium;
B. Argon;
C. Neon;
D. Krypton.
Đáp án: B
Giải thích:
Nguyên tử S (Z = 16) có 2 elctron ở lớp thứ nhất; 8 electron ở lớp thứ 2, và còn lại 6 electron ở lớp thứ 3.
Ion S2− được hình thành khi nguyên tử S nhận thêm 2 electron vào lớp thứ 3, tức là có 8 electron ở lớp thứ 3.
Khi đó ion S2− có lớp vỏ electron tương tự nguyên tử nguyên tố khí hiếm argon (Ar).
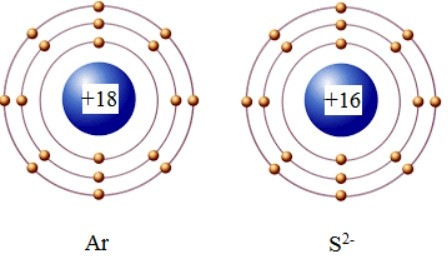
Câu 6. Liên kết cộng hóa trị là
A. liên kết được tạo thành bởi lực hút giữa ion dương và ion âm;
B. liên kết được tạo thành bởi một hoặc nhiều đôi electron dùng chung giữa hai nguyên tử;
C. liên kết được tạo thành bởi một hoặc nhiều đôi electron riêng giữa hai nguyên tử;
D. Cả B và C.
Đáp án: B
Giải thích:
Liên kết cộng hóa trị là liên kết được tạo thành bởi một hoặc nhiều đôi electron dùng chung giữa hai nguyên tử.
Câu 7. Chất nào sau đây không là chất cộng hóa trị
A. khí carbonic;
B. nước;
C. khí hydrogen;
D. magnesium oxide.
Đáp án: D
Giải thích:
Chất cộng hóa trị là chất được tạo thành nhờ liên kết cộng hóa trị giữa các nguyên tử.
Do đó, khí carbonic, nước, khí hydrogen là chất cộng hóa trị.
Magnesium oxide không là chất cộng hóa trị.
Câu 8. Nhận định nào sau đây sai khi nói về sự hình thành liên kết trong phân tử nước?
A. Nguyên tử O góp 2 electron;
B. Nguyên tử H góp 2 electron;
C. Giữa nguyên tử O và nguyên tử H có một đôi electron chung;
D. Hạt nhân của nguyên tử O và H cùng hút đôi electron dùng chung, liên kết với nhau tạo thành phân tử nước.
Đáp án: B
Giải thích:
Nhân định B sai vì mỗi nguyên tử H chỉ góp 1 electron.
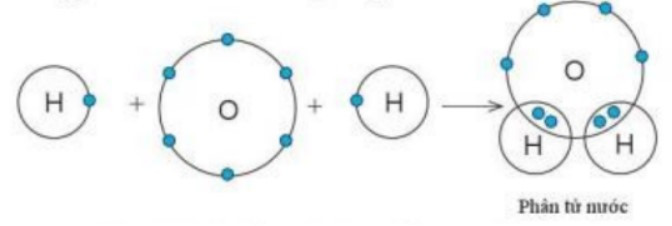
Câu 9. Tính chất nào sau đây không là tính chất chung của hợp chất ion?
A. Là chất rắn ở điều kiện thường;
B. Thường có nhiệt độ nóng chảy và nhiệt độ sôi thấp;
C. Khi tan trong nước tạo thành dung dịch dẫn được điện;
D. Đáp án khác.
Đáp án: B
Giải thích:
Tính chất không là tính chất chung của hợp chất ion là: Thường có nhiệt độ nóng chảy và nhiệt độ sôi thấp.
Vì các hợp chất ion thường có nhiệt độ nóng chảy và nhiệt độ sôi cao.
Câu 10. Cho các nhận định sau
1) Các chất cộng hóa trị là chất khí ở điều kiện thường.
2) Thường có nhiệt độ sôi, nhiệt độ nóng chảy thấp.
3) Chất cộng hóa trị đều dẫn điện.
Nhận định đúng là
A. 1, 2;
B. 2;
C. 2, 3;
D. 1, 3.
Đáp án: B
Giải thích:
1) Các chất cộng hóa trị là chất khí ở điều kiện thường. Sai vì tồn tại ở cả 3 thể (rắn, lỏng, khí)
2) Thường có nhiệt độ sôi, nhiệt độ nóng chảy thấp. Đúng.
3) Chất cộng hóa trị đều dẫn điện. Sai vì nhiều chất cộng hóa trị không dẫn điện.
Xem thêm câu hỏi trắc nghiệm Khoa học tự nhiên lớp 7 Cánh diều có đáp án hay khác:
Trắc nghiệm KHTN 7 Bài 4: Phân tử, đơn chất, hợp chất
Trắc nghiệm KHTN 7 Bài 5: Giới thiệu về liên kết hóa học
Trắc nghiệm KHTN 7 Bài 6: Hóa trị. Công thức hóa học
Xem thêm các chương trình khác:
