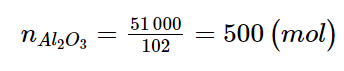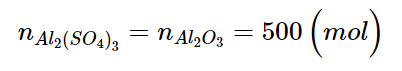Giải KHTN 8 Bài 12 (Cánh diều): Muối
Với lời giải bài tập Khoa học tự nhiên lớp 8 Bài 12: Muối sách Cánh diều hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi và làm bài tập KHTN 8 Bài 12.
Giải KHTN 8 Bài 12: Muối
Trả lời:
- Muối là những hợp chất được tạo ra khi thay thế ion H+ trong acid bằng ion kim loại hoặc ion ammonium (NH4+).
- Tính chất hoá học của muối:
+ Dung dịch muối có thể tác dụng với kim loại tạo thành muối mới và kim loại mới.
+ Muối có thể tác dụng với dung dịch acid tạo thành muối mới và acid mới.
+ Muối có thể tác dụng với dung dịch base tạo thành muối mới và base mới.
+ Hai dung dịch muối có thể tác dụng với nhau tạo thành hai muối mới.
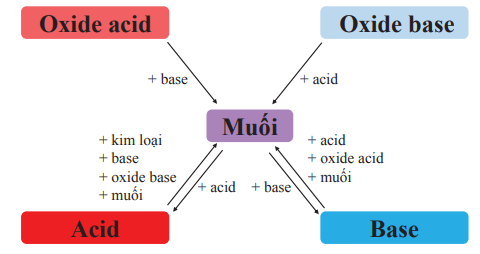
- Mối liên hệ giữa muối và các hợp chất khác được thể hiện bằng sơ đồ sau:
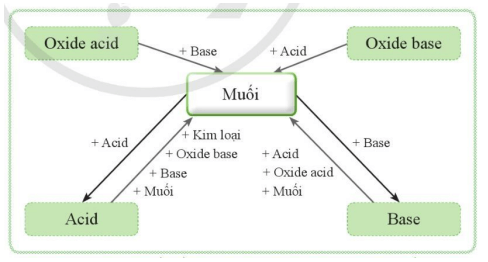
I. Khái niệm muối
Trả lời:
|
Muối |
Na3PO4 |
MgCl2 |
CaCO3 |
CuSO4 |
KNO3 |
|
Acid tương ứng |
H3PO4 |
HCl |
H2CO3 |
H2SO4 |
HNO3 |
II. Tên gọi của muối
Trả lời:
|
Công thức hoá học |
Tên gọi |
|
KCl |
Potassium chloride |
|
ZnSO4 |
Zinc sulfate |
|
MgCO3 |
Magnesium carbonate |
|
Ca3(PO4)2 |
Calcium phosphate |
|
Cu(NO3)2 |
Copper(II) nitrate |
|
Al2(SO4)3 |
Aluminium sulfate |
III. Tính tan của muối
Trả lời:
Các muối tan trong nước là: K2SO4, Na2CO3, AgNO3, KCl, CaCl2, MgSO4.
IV. Tính chất hoá học của muối
Trả lời:
- Phương trình hoá học xảy ra: Zn + CuSO4 → ZnSO4 + Cu.
- Dự đoán sự thay đổi màu của dung dịch: Dung dịch nhạt màu dần đến mất màu.
Luyện tập 4 trang 64 KHTN 8: Viết phương trình hoá học của phản ứng xảy ra trong các trường hợp sau:
a) Cho Fe vào dung dịch CuSO4.
b) Cho Zn vào dung dịch AgNO3.
Trả lời:
Phương trình hoá học xảy ra:
● Dụng cụ: Giá để ống nghiệm, ống nghiệm, ống hút nhỏ giọt, miếng bìa màu trắng.
● Hoá chất: Mẩu dây đồng, dung dịch AgNO3.
● Mô tả các hiện tượng xảy ra.
● Bề mặt sợi dây đồng và màu dung dịch trong ống nghiệm thay đổi như thế nào? Giải thích.
Trả lời:
- Hiện tượng: Mẩu dây đồng tan dần, có lớp kim loại trắng bạc bám ngoài dây đồng, dung dịch sau phản ứng có màu xanh.
- Bề mặt sợi dây đồng có lớp kim loại trắng bạc, dung dịch trong ống nghiệm đậm màu dần. Do dung dịch AgNO3 đã phản ứng với kim loại Cu theo phương trình hoá học sau:
2AgNO3 + Cu → Cu(NO3)2 + 2Ag↓.
Dung dịch Cu(NO3)2 có màu xanh.
● Dụng cụ: Giá để ống nghiệm, ống nghiệm, ống hút nhỏ giọt.
● Hoá chất: Dung dịch BaCl2, dung dịch H2SO4 loãng.
● Mô tả các hiện tượng xảy ra. Giải thích.
Trả lời:
- Hiện tượng: Xuất hiện kết tủa trắng.
- Giải thích: Dung dịch BaCl2 phản ứng với dung dịch H2SO4 tạo thành kết tủa trắng là BaSO4. Phương trình hoá học:
BaCl2 + H2SO4 → BaSO4↓ + 2HCl.
Luyện tập 5 trang 65 KHTN 8: Dự đoán các hiện tượng xảy ra trong các thí nghiệm sau:
a) Nhỏ dung dịch H2SO4 loãng vào dung dịch Na2CO3.
b) Nhỏ dung dịch HCl loãng vào dung dịch AgNO3.
Giải thích và viết phương trình hoá học xảy ra (nếu có).
Trả lời:
● Dụng cụ: Giá để ống nghiệm, ống nghiệm, ống hút nhỏ giọt.
● Hoá chất: Dung dịch CuSO4, dung dịch NaOH.
● Mô tả các hiện tượng xảy ra. Giải thích.
Trả lời:
- Hiện tượng: Xuất hiện kết tủa xanh, dung dịch nhạt màu dần.
- Giải thích: CuSO4 tác dụng với NaOH sinh ra kết tủa Cu(OH)2 có màu xanh. Phương trình hoá học: CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4.
Luyện tập 6 trang 65 KHTN 8: Viết phương trình hoá học xảy ra trong các trường hợp sau:
a) Dung dịch FeCl3 tác dụng với dung dịch NaOH.
b) Dung dịch CuCl2 tác dụng với dung dịch KOH.
Trả lời:
a) FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
Luyện tập 7 trang 65 KHTN 8: Hoàn thành các phương trình hoá học theo các sơ đồ sau:
Trả lời:
a) MgO + H2SO4 → MgSO4 + H2O
b) 2KOH + CuCl2 → Cu(OH)2↓ + 2KCl.
● Dụng cụ: Giá để ống nghiệm, ống nghiệm, ống hút nhỏ giọt.
● Hoá chất: Dung dịch Na2CO3, dung dịch CaCl2.
Mô tả các hiện tượng xảy ra. Giải thích.
Trả lời:
- Hiện tượng: Xuất hiện kết tủa trắng.
- Giải thích: Dung dịch Na2CO3 tác dụng với dung dịch CaCl2 sinh ra kết tủa trắng là CaCO3 theo phương trình hoá học:
Na2CO3 + CaCl2 → CaCO3↓ + 2NaCl.
V. Mối quan hệ giữa acid, base, oxide và muối
Luyện tập 8 trang 66 KHTN 8: Viết phương trình hoá học xảy ra giữa các dung dịch sau:
a) Dung dịch NaCl với dung dịch AgNO3.
b) Dung dịch Na2SO4 với dung dịch BaCl2.
c) Dung dịch K2CO3 với dung dịch Ca(NO3)2.
Trả lời:
a) NaCl + AgNO3 → AgCl↓ + NaNO3.
b) Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl.
c) K2CO3 + Ca(NO3)2 → CaCO3↓ + 2KNO3.
Luyện tập 9 trang 66 KHTN 8: Viết các phương trình hoá học theo sơ đồ chuyển hoá sau:
Trả lời:
Các phương trình hoá học theo sơ đồ:
(1) CuO + H2SO4 → CuSO4 + H2O.
Luyện tập 10 trang 67 KHTN 8: Viết ba phương trình hoá học khác nhau để tạo ra Na2SO4 từ NaOH.
Trả lời:
Ba phương trình hoá học khác nhau để tạo ra Na2SO4 từ NaOH là:
(1) 2NaOH + SO3 → Na2SO4 + H2O.
(2) 2NaOH + H2SO4 → Na2SO4 + 2H2O.
(3) 2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓.
Luyện tập 11 trang 67 KHTN 8: Viết ba phương trình hoá học khác nhau để điều chế CuCl2.
Trả lời:
Ba phương trình hoá học khác nhau để điều chế CuCl2:
(1) CuO + 2HCl → CuCl2 + H2O.
(2) Cu(OH)2 + 2HCl → CuCl2 + 2H2O.
Xem thêm lời giải bài tập KHTN 8 Cánh diều hay, chi tiết khác:
Xem thêm các chương trình khác:
- Soạn văn lớp 8 Cánh diều (hay nhất)
- Văn mẫu lớp 8 - Cánh diều
- Tóm tắt tác phẩm Ngữ văn 8 – Cánh diều
- Bố cục tác phẩm Ngữ văn lớp 8 – Cánh diều
- Tác giả tác phẩm Ngữ văn lớp 8 - Cánh diều
- Giải SBT Ngữ văn 8 – Cánh diều
- Nội dung chính tác phẩm Ngữ văn lớp 8 – Cánh diều
- Soạn văn 8 Cánh diều (ngắn nhất)
- Giải sgk Toán 8 – Cánh diều
- Lý thuyết Toán 8 – Cánh diều
- Giải sbt Toán 8 – Cánh diều
- Giải sgk Tiếng Anh 8 – iLearn Smart World
- Giải sbt Tiếng Anh 8 - ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh 8 ilearn Smart World đầy đủ nhất
- Ngữ pháp Tiếng Anh 8 ilearn Smart World
- Bài tập Tiếng Anh 8 iLearn Smart World theo Unit có đáp án
- Giải sgk Lịch sử 8 – Cánh diều
- Lý thuyết Lịch sử 8 - Cánh diều
- Giải sbt Lịch sử 8 – Cánh diều
- Giải sgk Địa lí 8 – Cánh diều
- Lý thuyết Địa lí 8 - Cánh diều
- Giải sbt Địa lí 8 – Cánh diều
- Giải sgk Giáo dục công dân 8 – Cánh diều
- Lý thuyết Giáo dục công dân 8 – Cánh diều
- Giải sbt Giáo dục công dân 8 – Cánh diều
- Giải sgk Công nghệ 8 – Cánh diều
- Lý thuyết Công nghệ 8 - Cánh diều
- Giải sbt Công nghệ 8 – Cánh diều
- Giải sgk Tin học 8 – Cánh diều
- Lý thuyết Tin học 8 - Cánh diều
- Giải sbt Tin học 8 – Cánh diều
- Giải sgk Hoạt động trải nghiệm 8 – Cánh diều