Giải KHTN 8 Bài 2 (Cánh diều): Phản ứng hóa học và năng lượng của phản ứng hóa học
Với lời giải bài tập Khoa học tự nhiên lớp 8 Bài 2: Phản ứng hóa học và năng lượng của phản ứng hóa học sách Cánh diều hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi và làm bài tập KHTN 8 Bài 2.
Giải KHTN 8 Bài 2: Phản ứng hóa học và năng lượng của phản ứng hóa học
Trả lời:
- Nước được tạo thành từ nguyên tử của các nguyên tố hydrogen và oxygen.
- Nước có thể được tạo thành từ phản ứng đốt cháy hydrogen trong oxygen.
I. Phản ứng hoá học là gì?
Trả lời:
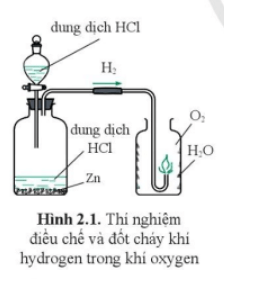
Trong hình 2.1 có những quá trình biến đổi hoá học xảy ra là:
+ Quá trình cho dung dịch HCl vào bình chứa Zn sinh ra khí H2.
+ Quá trình đốt cháy hydrogen trong bình chứa oxygen tạo thành nước (H2O).
a) Đốt cháy methane tạo thành khí carbon dioxide và nước.
b) Carbon (thành phần chính của than) cháy trong khí oxygen tạo thành khí carbon dioxide.
Trả lời:
a) Đốt cháy methane tạo thành khí carbon dioxide và nước:
+ Chất tham gia phản ứng là methane và oxygen.
+ Chất sản phẩm là carbon dioxide và nước.
b) Carbon (thành phần chính của than) cháy trong khí oxygen tạo thành khí carbon dioxide:
+ Chất tham gia phản ứng là carbon và khí oxygen.
+ Chất sản phẩm là khí carbon dioxide.
II. Diễn biến của phản ứng hoá học
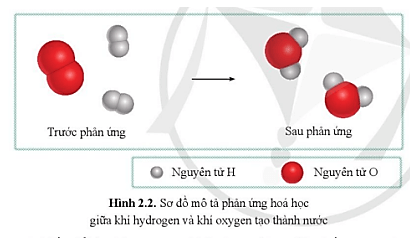
Câu hỏi 3 trang 17 KHTN 8: Quan sát sơ đồ hình 2.2, cho biết:
a) Trước phản ứng, những nguyên tử nào liên kết với nhau?
b) Sau phản ứng, những nguyên tử nào liên kết với nhau?
c) So sánh số nguyên tử H và số nguyên tử O trước và sau phản ứng.
Trả lời:
a) Trước phản ứng, 2 nguyên tử H liên kết với nhau; 2 nguyên tử O liên kết với nhau.
b) Sau phản ứng, 1 nguyên tử O liên kết với 2 nguyên tử H.
c) Số nguyên tử H và số nguyên tử O trước và sau phản ứng là bằng nhau.
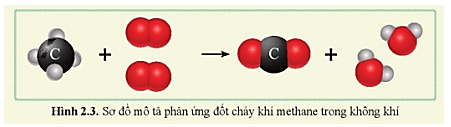
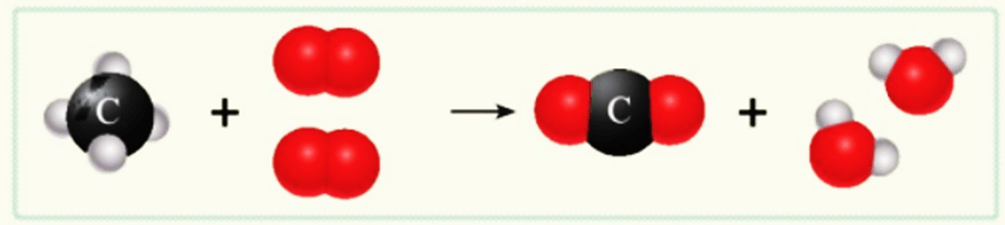
Quan sát sơ đồ hình 2.3 và cho biết:
a) Trước phản ứng có các chất nào, những nguyên tử nào liên kết với nhau?
b) Sau phản ứng, có các chất nào được tạo thành, những nguyên tử nào liên kết với nhau?
c) So sánh số nguyên tử C, H, O trước và sau phản ứng.
Trả lời:
a) Trước phản ứng có các chất methane (CH4) và oxygen (O2).
+ Methane (CH4) gồm 1 nguyên tử C liên kết với 4 nguyên tử H.
+ Oxygen (O2) gồm 2 nguyên tử O liên kết với nhau.
b) Sau phản ứng có các phân tử carbon dioxide (CO2) và nước (H2O) được tạo thành.
+ Carbon dioxide (CO2) gồm 1 nguyên tử C liên kết với 2 nguyên tử O.
+ Nước (H2O) gồm 2 nguyên tử H liên kết với 1 nguyên tử O.
c) Số nguyên tử C, H, O trước và sau phản ứng là bằng nhau.
III. Dấu hiệu có phản ứng hoá học xảy ra
Trả lời:
Trong phản ứng giữa khí hydrogen với khí oxygen, nước tạo ra không còn tính chất của hydrogen và oxygen nữa (nước ở thể lỏng, không cháy được, …)
• Dụng cụ: Ống nghiệm, đèn cồn, kẹp ống nghiệm.
• Cho khoảng một thìa cafe đường ăn vào ống nghiệm, sau đó đun trên ngọn lửa đèn cồn (hình 2.5).
• Mô tả trạng thái (thể, màu sắc, …) của đường trước và sau khi đun.
• Nêu dấu hiệu chứng tỏ có phản ứng hoá học xảy ra.
Trả lời:
- Trước khi đun: Đường là chất rắn, màu trắng, vị ngọt, không mùi, tan trong nước.
- Sau khi đun: Thu được chất rắn, màu đen, vị đắng, mùi khét, không tan trong nước.
- Dấu hiệu chứng tỏ có phản ứng hoá học xảy ra: có sự thay đổi màu sắc (từ trắng sang đen); vị (từ ngọt sang đắng); mùi (từ không mùi sang khét); độ tan (từ tan trong nước sang chất mới không tan trong nước).
Trả lời:
Dấu hiệu chứng tỏ có phản ứng hoá học xảy ra là sự thay đổi vị của nước đường (từ vị ngọt sang vị chua).
Luyện tập 2 trang 19 KHTN 8: Những dấu hiệu nào thường dùng để nhận biết có phản ứng hoá học xảy ra?
Trả lời:
+ Để nhận biết có phản ứng hoá học xảy ra có thể dựa vào các dấu hiệu sau: có sự thay đổi màu sắc, mùi, … của các chất; tạo ra chất khí hoặc chất không tan (kết tủa); …
+ Ngoài ra, sự toả nhiệt và phát sáng cũng có thể là dấu hiệu của phản ứng hoá học xảy ra.
IV. Phản ứng toả nhiệt, phản ứng thu nhiệt
• Dụng cụ: Kẹp sắt (panh), bình tam giác (loại 100 mL), đèn cồn, ống đong, thìa xúc hoá chất.
Trả lời:
Mẩu than cháy sáng trong bình khí oxygen. Chạm tay vào thành bình thấy nóng.
• Dụng cụ: Kẹp sắt (panh), bình tam giác (loại 100 mL), đèn cồn, ống đong, thìa xúc hoá chất.
Quan sát các hiện tượng xảy ra, nêu cảm nhận khi chạm tay vào thành bình.
Trả lời:
Bột NaHCO3 tan dần, có khí thoát ra. Chạm tay vào thành bình thấy lạnh.
Trả lời:
Nội dung đang được cập nhật
a) Phân huỷ đường tạo thành than và nước.
Trả lời:
a) Phân huỷ đường tạo thành than và nước là phản ứng thu nhiệt.
b) Đốt cháy cồn trong không khí là phản ứng toả nhiệt.
Trả lời:
- Một số phản ứng xảy ra trong tự nhiên là phản ứng thu nhiệt:
+ Phản ứng quang hợp (là phản ứng thu năng lượng dưới dạng ánh sáng).
+ Phản ứng nung vôi.
- Một số phản ứng xảy ra trong tự nhiên là phản ứng toả nhiệt:
+ Phản ứng tạo gỉ sắt.
+ Phản ứng oxi hoá glucose trong cơ thể.
Kiến thức trọng tâm KHTN 8 Bài 2: Phản ứng hóa học và năng lượng của phản ứng hóa học
I. Phản ứng hoá học là gì?
Phản ứng hoá học là quá trình biến đổi từ chất này thành chất khác.
Chất ban đầu bị biến đổi trong phản ứng được gọi là chất tham gia phản ứng, chất tạo thành sau phản ứng được gọi là chất sản phẩm.
Ví dụ:
Khi đun nóng hỗn hợp bột sắt (iron) và bột lưu huỳnh (sulfur) ta được hợp chất iron(II) sulfide (FeS).
+ Chất tham gia phản ứng là sắt và lưu huỳnh.
+ Chất sản phẩm là iron(II) sulfide.
II. Diễn biến của phản ứng hoá học
- Các biến đổi hoá học xảy ra khi có sự phá vỡ liên kết trong các chất tham gia phản ứng và sự hình thành các liên kết mới để tạo ra chất sản phẩm.
Sơ đồ mô tả phản ứng đốt cháy khí methane trong không khí thu được carbon dioxide và nước
- Trong phản ứng hoá học, chỉ có liên kết giữa các nguyên tử thay đổi làm cho phân tử này biến đổi thành phân tử khác, kết quả là chất này biến đổi thành chất khác. Số nguyên tử của mỗi nguyên tố trước và sau phản ứng không thay đổi.
III. Dấu hiệu có phản ứng hoá học xảy ra
Để nhận biết có phản ứng hoá học xảy ra có thể dựa vào các dấu hiệu sau:
- Có sự thay đổi màu sắc, mùi, … của các chất; tạo ra chất khí hoặc chất không tan (kết tủa); …
Ví dụ: Trong phản ứng của sắt tác dụng với hydrochloric acid, quan sát thấy có bọt khí bay lên.
- Có sự toả nhiệt và phát sáng
Sự toả nhiệt và phát sáng cũng có thể là dấu hiệu của phản ứng hoá học xảy ra.
Ví dụ: Khi đốt nến, nến cháy có sự toả nhiệt và phát sáng.
IV. Phản ứng toả nhiệt, phản ứng thu nhiệt
1. Khái niệm
Phản ứng hoá học khi xảy ra luôn kèm theo sự toả ra hoặc thu vào năng lượng (thường dưới dạng nhiệt), năng lượng này được gọi là năng lượng của phản ứng hoá học.
+ Phản ứng toả ra năng lượng (dưới dạng nhiệt) được gọi là phản ứng toả nhiệt. Phản ứng toả nhiệt làm nóng môi trường xung quanh.
Ví dụ: Phản ứng đốt cháy than; phản ứng đốt cháy xăng, dầu trong các động cơ; …
+ Phản ứng thu vào năng lượng (dưới dạng nhiệt) được gọi là phản ứng thu nhiệt. Phản ứng thu nhiệt làm lạnh môi trường xung quanh.
Ví dụ: Phản ứng nung vôi (phân huỷ CaCO3 thành CaO và CO2).
2. Ứng dụng của phản ứng toả nhiệt
- Trong sản xuất và đời sống, các phản ứng toả nhiệt có ứng dụng chính là cung cấp năng lượng nhiệt (nhiệt năng) cho các ngành công nghiệp, làm cho các động cơ hay máy phát điện hoạt động.
- Nhiệt năng thu được khi đốt cháy các nhiên liệu như than, xăng, dầu, … có thể được dùng để đun nấu, sưởi ấm, thắp sáng, … Than được sử dụng chủ yếu làm nhiên liệu trong công nghiệp. Xăng, dầu được sử dụng chủ yếu trong vận hành các máy móc, phương tiện giao thông như: xe máy, ô tô, tàu thuỷ, …
Xem thêm lời giải bài tập Khoa học tự nhiên lớp 8 Cánh diều hay, chi tiết khác:
Bài 3: Định luật bảo toàn khối lượng. Phương trình hóa học
Bài 4: Mol và tỉ khối của chất khí
Xem thêm các chương trình khác:
- Soạn văn lớp 8 Cánh diều (hay nhất)
- Văn mẫu lớp 8 - Cánh diều
- Tóm tắt tác phẩm Ngữ văn 8 – Cánh diều
- Bố cục tác phẩm Ngữ văn lớp 8 – Cánh diều
- Tác giả tác phẩm Ngữ văn lớp 8 - Cánh diều
- Giải SBT Ngữ văn 8 – Cánh diều
- Nội dung chính tác phẩm Ngữ văn lớp 8 – Cánh diều
- Soạn văn 8 Cánh diều (ngắn nhất)
- Giải sgk Toán 8 – Cánh diều
- Lý thuyết Toán 8 – Cánh diều
- Giải sbt Toán 8 – Cánh diều
- Giải sgk Tiếng Anh 8 – iLearn Smart World
- Giải sbt Tiếng Anh 8 - ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh 8 ilearn Smart World đầy đủ nhất
- Ngữ pháp Tiếng Anh 8 ilearn Smart World
- Bài tập Tiếng Anh 8 iLearn Smart World theo Unit có đáp án
- Giải sgk Lịch sử 8 – Cánh diều
- Lý thuyết Lịch sử 8 - Cánh diều
- Giải sbt Lịch sử 8 – Cánh diều
- Giải sgk Địa lí 8 – Cánh diều
- Lý thuyết Địa lí 8 - Cánh diều
- Giải sbt Địa lí 8 – Cánh diều
- Giải sgk Giáo dục công dân 8 – Cánh diều
- Lý thuyết Giáo dục công dân 8 – Cánh diều
- Giải sbt Giáo dục công dân 8 – Cánh diều
- Giải sgk Công nghệ 8 – Cánh diều
- Lý thuyết Công nghệ 8 - Cánh diều
- Giải sbt Công nghệ 8 – Cánh diều
- Giải sgk Tin học 8 – Cánh diều
- Lý thuyết Tin học 8 - Cánh diều
- Giải sbt Tin học 8 – Cánh diều
- Giải sgk Hoạt động trải nghiệm 8 – Cánh diều