Sách bài tập KHTN 9 Bài 20 (Cánh diều): Hydrocarbon, alkane
Với giải sách bài tập Khoa học tự nhiên 9 Bài 20: Hydrocarbon, alkane sách Cánh diều hay nhất, ngắn gọn sẽ giúp học sinh dễ dàng làm bài tập trong SBT KHTN 9 Bài 20.
Giải SBT KHTN 9 Bài 20: Hydrocarbon, alkane
Bài 20.1 trang 58 Sách bài tập KHTN 9: Số lượng alkane trong các hợp chất sau: C3H8, C2H6O, C6H6, CH4, C2H5Cl, C4H10 là:
A. 2
B. 3
C. 4
D. 5
Lời giải:
Đáp án đúng là: B
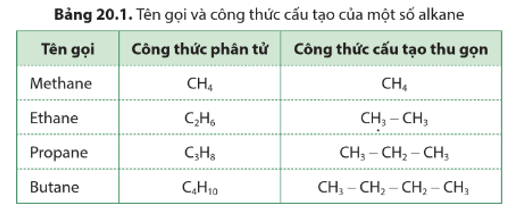
Alkane là những hydrocarbon mạch hở, chỉ chứa các liên kết đơn trong phân tử, có công thức chung là C2H2n+2 ().
Các chất là alkane trong dãy là: C3H8, CH4, C4H10.
Bài 20.2 trang 58 Sách bài tập KHTN 9: Bài 20.2 trang 58 Sách bài tập KHTN 9:
A. CO2.
B. H2O.
C. CO2 và H2O.
D. CO2 và H2.
Lời giải:
Đáp án đúng là: C
Khi đốt cháy hoàn toàn alkane sẽ tạo ra sản phẩm là CO2 và H2O.
Ví dụ:
Bài 20.3 trang 58 Sách bài tập KHTN 9: Số lượng alkane có cùng công thức phân tử C5H12 nhưng có công thức cấu tạo khác nhau là:
A. 1
B. 2
C. 3
D. 4
Lời giải:
Đáp án đúng là: C
Số lượng alkane có cùng công thức phân tử C5H12 nhưng có công thức cấu tạo khác nhau là 3. Cụ thể:
CH3 – CH2 – CH2 – CH2 – CH3,
CH3 – CH(CH3) – CH2 – CH3,
CH3 – C(CH3)2 – CH3.
Bài 20.4 trang 58 Sách bài tập KHTN 9: Alkane được sử dụng chủ yếu để làm:
A. nhiên liệu.
B. thuốc trừ sâu.
C. phân bón.
D. nguyên liệu sản xuất thuốc.
Lời giải:
Đáp án đúng là: A
Alkane được sử dụng chủ yếu để làm nhiên liệu vì các alkane cháy thường sinh ra nhiều nhiệt. Ví dụ: Methane là thành phần chính của khí thiên nhiên, khí mỏ dầu, biogas,… được dùng để đun nấu, làm nhiên liệu trong các nhà máy luyện kim, gốm sứ, nhà máy điện,…
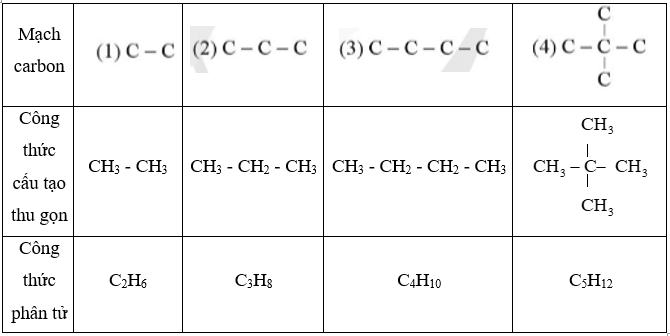
Bài 20.5 trang 58 Sách bài tập KHTN 9: Một số alkane có mạch carbon trong phân tử như saư:
Viết công thức cấu tạo thu gọn và công thức phân tử của các alkane trên.
Lời giải:
Công thức phân tử và công thức cấu tạo thu gọn của các alkane trên là:
Bài 20.6 trang 58 Sách bài tập KHTN 9: Alkane X có khối lượng phân tử là 58 amu.
a) Xác định công thức phân tử của alkane X.
b) Biết alkane X có mạch carbon không phân nhánh, viết công thức cấu tạo và tên gọi của alkane X.
Lời giải:
a) Alkane X có khối lượng phân tử là 58 amu, X có công thức phân tử dạng: CnH2n+2.
Ta có:
Vậy công thức phân tử của X là C4H10.
b) Vì alkane X có mạch carbon không phân nhánh nên công thức cấu tạo của X là:
CH3 – CH2 – CH2 – CH3, tên gọi: butane.
Bài 20.7 trang 58 Sách bài tập KHTN 9: Viết phương trình hoá học của phản ứng đốt cháy ethane, propane và butane. Nhận xét về tỉ lệ số mol H2O và số mol CO2 tạo ra trong các phản ứng đốt cháy trên.
Lời giải:
Phương trình hoá học của phản ứng đốt cháy:
Tỉ lệ số mol H2O : số mol CO2:
Bài 20.8 trang 58 Sách bài tập KHTN 9: Chọn những câu đúng trong các câu sau:
a) Trong phân tử hydrocarbon, nếu tỉ lệ giữa số nguyên tử H và C lớn hơn hai lần thì đó là alkane.
b) Tất cả các hydrocarbon trong phân tử chỉ có các liên kết đơn đều là alkane.
c) Hydrocarbon có tỉ lệ số nguyên tử H và C lớn hơn 2 thì trong phân tử chỉ có các liên kết đơn.
d) Tất cả các hydrocarbon chỉ có liên kết đơn trong phân tử đều có công thức chung là CnH2n+2.
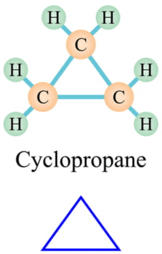
e) Những hydrocarbon chỉ có liên kết đơn nhưng có mạch carbon dạng vòng không phải là alkane.
Lời giải:
Những câu đúng là: (a), (c), (e).
(b) sai vì có trường hợp các hydrocarbon trong phân tử chỉ có các liên kết đơn nhưng không phải là alkane. Ví dụ:
(d) sai vì cycloalkane chỉ có liên kết đơn trong phân tử, nhưng có công thức chung là CnH2n.
Bài 20.9 trang 59 Sách bài tập KHTN 9: Đốt cháy hoàn toàn 160 gam hỗn hợp A gồm C4H10 và C3H8 thấy tạo ra 484 gam khí CO2.
a) Viết phương trình hoá học của phản ứng đốt cháy các alkane trên.
b) Tính thành phần phần trăm thể tích của mỗi alkane trong hỗn hợp A.
c) Tính lượng nhiệt toả ra trong quá trình trên, biết lượng nhiệt toả ra khi đốt cháy hoàn toàn 1 gam mỗi chất C4H10 và C3H8 lần lượt là 49,5 kJ và 50,35 kJ.
Lời giải:
a) Phương trình hoá học của phản ứng đốt cháy các alkane:
b) Gọi số mol C4H10 và C3H8 trong hỗn hợp lần lượt là x và y.
Theo đề bài ta có: 58x + 44y = 160 (I)
Số mol của CO2 tạo ra khi đốt cháy x mol C4H10 và y mol C3H8 là: 4x + 3y
Theo bài, số mol CO2 tạo ra là:
Vậy: 4x + 3y = 11 (II)
Từ (I) và (II) ta tìm được: x = 2, y = 1.
Thành phần % thể tích bằng thành phần % theo số mol nên:
% thể tích của C4H10 trong hỗn hợp A là:
% thể tích của C3H8 trong hỗn hợp A là:
c) Lượng nhiệt toả ra khi đốt cháy hoàn toàn 160 gam hỗn hợp A là:
Q = 49,5 . 2 . 58 + 50,35 . 1 . 44 = 7 957, 4(kJ).
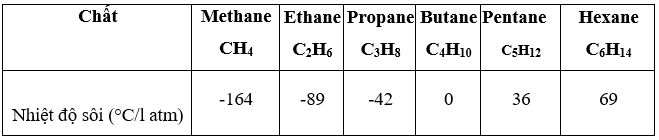
Bài 20.10 trang 59 Sách bài tập KHTN 9: Nhiệt độ sôi của một số alkane được nêu trong bảng sau:
a) Ở 25 °C và dưới áp suất của khí quyển (khoảng 1 atm), những hydrocarbon nào ở trạng thái khí, lỏng?
b) Gas dùng dể đun nấu được đựng trong các bình bằng thép là hỗn hợp với thành phần chính là propane và butane, còn gas dùng trong bật lửa gas chủ yếu là butane. Cho biết sự khác nhau trên có ý nghĩa gì.
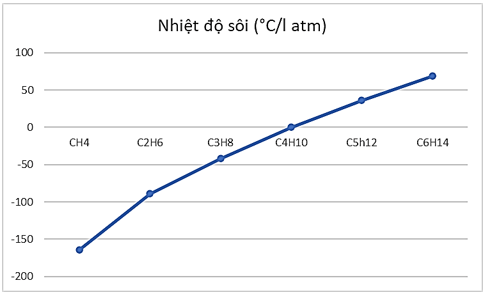
c) Vẽ đồ thị sự phụ thuộc của nhiệt độ sôi vào số nguyên tử C trong phân tử. Nhận xét sự thay đổi nhiệt độ sôi của alkane theo số nguyên tử carbon trong phân tử.
Lời giải:
a) Ở 25 °C và dưới áp suất của khí quyển (khoảng 1 atm), những hydrocarbon ở trạng thái khí: CH4, C2H6, C3H8, C4H10; những hydrocarbon ở trạng thái lỏng: C5H12, C6H14.
b) Propane có nhiệt độ sôi thấp -42oC, vì vậy, khi hoá lỏng ở nhiệt độ thường, cần có áp suất cao (đựng trong bình thép).
Với bật lửa và bình gas mini để chống hiện tượng bị nổ người ta dùng butane có nhiệt độ sôi cao hơn (0 oC) và khi hoá lỏng ở nhiệt độ thường có áp suất nhỏ hơn.
Học sinh tham khảo đồ thị sau:
Nhận xét: Khi số nguyên tử C trong phân tử tăng lên, nhiệt độ sôi của alkane tăng lên.
Lý thuyết KHTN 9 Bài 20: Hydrocarbon, alkane
I. KHÁI NIỆM HYDROCARBON
- Hydrocarbon là những hợp chất hữu cơ được tạo thành từ hai nguyên tố carbon và hydrogen.
- Công thức chung của các hydrocarbon là CxHy, trong đó x và y lần lượt là số nguyên tử C và H trong phân tử.
Ví dụ: CH4, C2H4, C4H6,…
- Ở điều kiện thường, một số hydrocarbon là chất khí, còn lại là chất lỏng hoặc rắn. Các hydrocarbon đều nhẹ hơn nước và hầu như không tan trong nước.
II. ALKANE
1. Khái niệm
- Alkane là những hydrocarbon mạch hở, chỉ chứa các liên kết đơn trong phân tử.
- Công thức chung của các alkane là CnH2n+2 ( ), trong đó n là số nguyên tử C trong phân tử.
2. Phản ứng cháy
- Alkane dễ cháy, tạo ra CO2, H2O và sinh ra nhiều nhiệt.
- Ví dụ: Phản ứng cháy của butane:
3. Ứng dụng làm nhiên liệu của alkane
- Các alkane cháy thường sinh ra nhiều nhiệt. Vì vậy, chúng trở thành nguồn nhiên liệu quan trọng được sử dụng rộng rãi trong nhiều lĩnh vực của đời sống và sản xuất.
+ Methane là thành phần chính của khí thiên nhiên, khí mỏ dầu, biogas,… được dùng để đun nấu, làm nhiên liệu cho các nhà máy luyện kim, gốm sứ, nhà máy điện,…
+ Propane, butane là thành phần chính của khí hoá lỏng (LPG) được dùng để đun nấu, làm nhiên liệu cho một số động cơ, chạy máy phát điện,…
+ Xăng, dầu hoả, dầu diesel với thành phần chính là các alkane ở thể lỏng được sử dụng làm nhiên liệu cho các loại phương tiện giao thông vận tải và nhiều loại động cơ khác.
Xem thêm các chương trình khác:
- Soạn văn 9 Cánh diều (hay nhất)
- Văn mẫu 9 - Cánh diều
- Tóm tắt tác phẩm Ngữ văn 9 – Cánh diều
- Tác giả tác phẩm Ngữ văn 9 - Cánh diều
- Bố cục tác phẩm Ngữ văn 9 – Cánh diều
- Nội dung chính tác phẩm Ngữ văn 9 – Cánh diều
- Soạn văn 9 Cánh diều (ngắn nhất)
- Giải sgk Toán 9 – Cánh diều
- Lý thuyết Toán 9 – Cánh diều
- Giải sbt Toán 9 – Cánh diều
- Giải sgk Tiếng Anh 9 - ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh lớp 9 ilearn Smart World đầy đủ nhất
- Trọn bộ Ngữ pháp Tiếng Anh lớp 9 ilearn Smart World đầy đủ nhất
- Giải sbt Tiếng Anh 9 – iLearn Smart World
- Bài tập Tiếng Anh 9 iLearn Smart World theo Unit có đáp án
- Giải sgk Lịch sử 9 – Cánh diều
- Giải sbt Lịch sử 9 – Cánh diều
- Giải sgk Địa lí 9 – Cánh diều