Sách bài tập KHTN 9 Bài 16 (Cánh diều): Dãy hoạt động hoá học
Với giải sách bài tập Khoa học tự nhiên 9 Bài 16: Dãy hoạt động hoá học sách Cánh diều hay nhất, ngắn gọn sẽ giúp học sinh dễ dàng làm bài tập trong SBT KHTN 9 Bài 16.
Giải SBT KHTN 9 Bài 16: Dãy hoạt động hoá học
Bài 16.1 trang 47 Sách bài tập KHTN 9: Dựa vào khả năng và mức độ phản ứng của kim loại với một số chất sẽ:
A. So sánh được tính chất hoá học giữa các kim loại.
B. So sánh được mức độ hoạt động hoá học của các kim loại với nhau.
C. Xác định được tính chất hoá học của một số kim loại.
D. So sánh được tính kim loại giữa nguyên tử của các nguyên tố kim loại.
Lời giải:
Đáp án đúng là: B
Dựa vào khả năng và mức độ phản ứng của kim loại với một số chất sẽ: So sánh được mức độ hoạt động hoá học của các kim loại với nhau.
Bài 16.2 trang 47 Sách bài tập KHTN 9: Phát biểu nào sau đây không đúng về dãy hoạt động hoá học?
A. Dãy hoạt động hoá học cho biết mức độ hoạt động hoá học của kim loại (và H) với nhau.
B. Dãy hoạt động hoá học được xây dựng từ kết quả của các quá trình thí nghiệm.
C. Từ dãy hoạt động hoá học sẽ nhận ra bạc có mức độ hoạt động hoá học mạnh hơn đồng.
D. Từ dãy hoạt động hoá học sẽ nhận ra vàng là kim loại có mức độ hoạt động hoá học rất yếu.
Lời giải:
Đáp án đúng là: C
Do: Bạc có mức độ hoạt động hoá học yếu hơn đồng.
Bài 16.3 trang 48 Sách bài tập KHTN 9: Mỗi phát biểu dưới đây là đúng hay sai?
A. Các kim loại từ Mg trở về sau đều không phản ứng với nước ở nhiệt độ thường.
B. Các kim loại đứng trước H đều không phản ứng với dung dịch hydrochloric acid.
C. Các kim loại đứng sau H đều không phản ứng với dung dịch sulfuric acid loãng.
D. Khi tác dụng với dung dịch acid cùng nồng độ và nhiệt độ thì lá Mg phản ứng mãnh liệt hơn so với lá Zn.
Lời giải:
A. Đúng.
B. Sai, vì các kim loại đứng sau H đều không phản ứng với dung dịch hydrochloric acid.
C. Đúng.
D. Đúng.
Bài 16.4 trang 48 Sách bài tập KHTN 9: Hình 16.1 cho biết xu hướng biến đổi mức độ hoạt động hoá học của một số kim loại.
a) Chiều mũi tên chỉ xu hướng tăng hay giảm độ hoạt động hoá học của các kim loại?
b) Kim loại nào cần bảo quản trong dầu hoả?
c) Trong không khí, kim loại nào ít bị biến đổi thành chất khác?
d) Kim loại nào phản ứng được với nước ở nhiệt độ thường?
e) Chất nào có thể phản ứng với nhiều kim loại trong hình 16.1 để tạo ra chất khí?
Lời giải:
a) Chiều mũi tên chỉ xu hướng tăng độ hoạt động hoá học của các kim loại.
b) Kim loại natri (sodium) cần bảo quản trong dầu hoả.
c) Trong không khí, kim loại bạc (silver) ít bị biến đổi thành chất khác.
d) Kim loại natri (sodium), calcium phản ứng được với nước ở nhiệt độ thường.
e) Các dung dịch acid (HCl, H2SO4 loãng …) có thể phản ứng với nhiều kim loại trong hình 16.1 để tạo ra chất khí.
Bài 16.5 trang 48 Sách bài tập KHTN 9: Dựa vào dãy hoạt động hoá học, cho biết phản ứng nào dưới đây là đúng?
A. Pb(NO3)2 + Cu → Cu(NO3)2 + Pb
B. Zn + 2H2O (lỏng) → Zn(OH)2 + H2
C. 2Ag + H2SO4 (loãng) → Ag2SO4 + H2
D. Mg + Pb(NO3)2 → Mg(NO3)2 + Pb
Lời giải:
Đáp án đúng là: D
Mg + Pb(NO3)2 → Mg(NO3)2 + Pb
A sai vì Cu hoạt động hoá học kém hơn Pb, không đẩy được Pb ra khỏi muối.
B sai vì Zn không tác dụng với H2O ở điều kiện thường.
C sai vì Ag không tác dụng với H2SO4 loãng.
Bài 16.6 trang 48 Sách bài tập KHTN 9: Trong các kim loại gồm Pb, Zn, Al, Fe, Ag và K, kim loại nào:
a) phản ứng với nước tạo ra dung dịch base?
b) phản ứng với dung dịch sulfuric acid loãng tạo ra khí hydrogen?
c) phản ứng với dung dịch copper(II) sulfate tạo ra kim loại?
d) phản ứng với dung dịch copper(II) sulfate tạo ra khí hydrogen?
Lời giải:
a) Kim loại K phản ứng với nước tạo thành dung dịch base.
2K + 2H2O → 2KOH + H2
b) Các kim loại Pb, Zn, Al, Fe, K phản ứng với dung dịch sulfuric acid loãng tạo ra khí hydrogen.
Pb + H2SO4 loãng → PbSO4 + H2
Zn + H2SO4 loãng → ZnSO4 + H2
2Al + 3H2SO4 loãng → Al2(SO4)3 + 3H2
Fe + H2SO4 loãng → FeSO4 + H2
2K + H2SO4 loãng → K2SO4 + H2
c) Các kim loại Pb, Zn, Al, Fe phản ứng với dung dịch copper(II) sulfate tạo ra kim loại.
Pb + CuSO4 → PbSO4 + Cu
Zn + CuSO4 → ZnSO4 + Cu
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
Fe + CuSO4 → FeSO4 + Cu
d) Kim loại K phản ứng với dung dịch copper(II) sulfate tạo ra khí hydrogen.
2K + 2H2O → 2KOH + H2
CuSO4 + 2KOH → Cu(OH)2 + K2SO4
Bài 16.7 trang 49 Sách bài tập KHTN 9: Để so sánh mức độ hoạt động hoá học giữa các kim loại Li, Na, K, người ta cho mẩu nhỏ của mỗi kim loại này vào từng cốc nước riêng biệt có hoà tan vài giọt phenolphthalein. Bảng 16.1 dưới đây mô tả hiện tượng quan sát được.
a) Viết phương trình hoá học của các phản ứng xảy ra.
b) Có thể xác nhận bọt khí chính là khí hydrogen bằng cách nào?
c) Từ các hiện tượng nêu trong bảng 16.1, hãy sắp xếp các kim loại Li, Na, K thành dãy giảm dần mức độ hoạt động hoá học.
Lời giải:
a) Viết phương trình hoá học của các phản ứng xảy ra:
2Li + 2H2O → 2LiOH + H2
2Na + 2H2O → 2NaOH + H2
2K + 2H2O → 2KOH + H2
b) Có thể xác nhận bọt khí chính là khí hydrogen bằng cách: dùng ống nghiệm nhỏ hứng khí vào ống nghiệm rồi đưa gần miệng ống nghiệm vào ngọn lửa đèn cồn. Nếu xuất hiện tiếng bụp nhỏ, kèm theo hơi nước bám thành ống nghiệm thì khí chính là hydrogen.
2H2 + O2 2H2O
c) Sắp xếp các kim loại thành dãy giảm dần mức độ hoạt động hoá học:
K, Na, Li.
Bài 16.8 trang 49 Sách bài tập KHTN 9: Magnesium, calcium, strontium (Sr) là ba nguyên tố hoá học thuộc nhóm IIA trong bảng Hệ thống tuần hoàn các nguyên tố hoá học.
Cho các mẩu kim loại magnesium, calcium, strontium có kích thước tương tương vào cốc nước ở nhiệt độ phòng. Bảng 16.2 ghi lại một số hiện tượng quan sát được nhưng thiếu thông tin về hiện tượng xảy ra khi cho strontium tương tác với nước.
a) Dự đoán hiện tượng và nêu thông tin thích hợp điền vào dấu ? trong bảng 16.2.
b) Viết phương trình hoá học của các phản ứng xảy ra.
Lời giải:
a) Hiện tượng điền vào dấu ? trong bảng 16.2: Xuất hiện nhiều bọt khí làm cho mẩu kim loại chuyển động hỗn loạn trong nước và tan rất nhanh.
b) Viết phương trình hoá học của các phản ứng xảy ra:
Mg + 2H2O → Mg(OH)2 + H2
Ca + 2H2O → Ca(OH)2 + H2
Sr + 2H2O → Sr(OH)2 + H2
Bài 16.9 trang 49 Sách bài tập KHTN 9: Khi được cho vào dung dịch nước của chất bất kì, các kim loại hoạt động hoá học mạnh như K, Na, Ca sẽ ưu tiên phản ứng với nước trong dung dịch.
Cho mẩu Na nhỏ vào cốc đựng dung dịch copper(II) sulfate dư.
a) Dự đoán hiện tượng quan sát được và viết phương trình hoá học của các phản ứng xảy ra.
b) Có thể dùng K để đẩy Cu ra khỏi dung dịch muối được không? Giải thích.
Lời giải:
a) Dự đoán hiện tượng quan sát được: Có sủi bọt khí, xuất hiện kết tủa xanh nhạt, màu xanh của dung dịch nhạt dần.
Phương trình hoá học của các phản ứng xảy ra:
2Na + 2H2O → 2NaOH + H2↑
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
b) Không thể dùng K để đẩy Cu ra khỏi dung dịch muối do kim loại K hoạt động hoá học mạnh sẽ ưu tiên phản ứng với nước trước.
Bài 16.10 trang 50 Sách bài tập KHTN 9: Các kim loại có mức độ hoạt động hoá học mạnh thường tạo thành các hợp chất bền hơn so với các kim loại có mức độ hoạt động hoá học yếu.
Khi bị đun nóng, nhiều muối carbonate sẽ phân huỷ thành oxide base (hay basic oxide) và carbon dioxide. Nhiệt độ phân huỷ của calcium carbonate (CaCO3), magnesium carbonate (MgCO3) và silver carbonate (Ag2CO3) lần lượt vào khoảng 900 °C, 450 °C và 220 °C.
a) Theo em, vì sao nhiệt độ phân huỷ của các muối trên giảm dần?
b) Dự đoán xem sodium carbonate (hay soda) khó hay dễ bị phân huỷ hơn so với calcium carbonate. Vì sao?
Lời giải:
a) Mức độ hoạt động hoá học của các kim loại giảm dần theo dãy Ca, Mg, Ag. Vì vậy, hợp chất của chúng cũng giảm độ bền theo dãy: CaCO3, MgCO3, Ag2CO3.
b) Vì mức độ hoạt động hoá học của Na mạnh hơn Ca nên dự đoán hợp chất Na2CO3 bền và khó bị phân huỷ hơn hợp chất CaCO3.
Bài 16.11 trang 50 Sách bài tập KHTN 9: Thông thường, khi cùng nhúng hai kim loại có mức độ hoạt động hoá học khác nhau vào một dung dịch chứa chất tan phù hợp, nối hai kim loại ấy bằng một dây dẫn điện sẽ tạo được một pin. Hình 16.2 mô tả một pin, trong đó, lá đồng làm điện cực dương, lá nhôm làm điện cực âm. Pin này tạo dòng điện có hiệu điện thế là 2 V.
a) Tìm hiểu và cho biết một số cặp kim loại thường được sử dụng làm cặp điện cực để tạo pin tương tự hình 16.2.
b) Có thể sử dụng natri và đồng làm cặp điện cực cho một pin được không? Giải thích.
Lời giải:
a) Cặp kim loại Zn – Cu thường được sử dụng làm cặp điện cực để tạo pin tương tự hình 16.2. Trong đó Zn làm cực dương; Cu (hoạt động yếu hơn) làm cực âm.
b) Không thể sử dụng natri và đồng làm cặp điện cực cho một pin được do kim loại Na tác dụng được với nước.
Lý thuyết KHTN 9 Bài 16: Dãy hoạt động hoá học
I. TÍNH CHẤT VẬT LÍ CỦA KIM LOẠI
Các kim loại khác nhau nhưng đều có một số tính chất chung như tính dẻo, tính dẫn điện, tính dẫn nhiệt, tính ánh kim,…
1. Tính dẻo
- Kim loại có tính dẻo nên có thể rèn, kéo dài thành sợi hoặc dát mỏng. Dựa trên tính chất này, kim loại được dùng để tạo nên các đồ vật khác nhau như hộp đựng thức ăn bằng nhôm, dây đồng, giấy nhôm bọc thực phẩm,…
+ Các kim loại khác nhau thường có tính dẻo khác nhau. Những kim loại có tính dẻo cao là Au, Ag, Al, Cu, Fe…
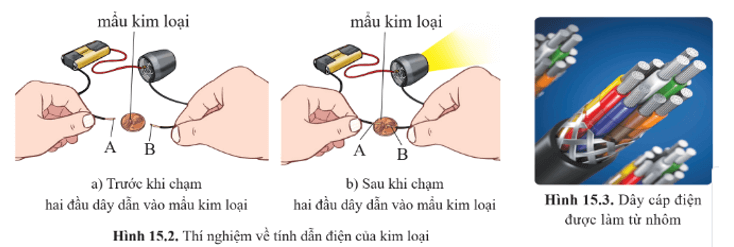
2. Tính dẫn điện
- Kim loại có tính dẫn điện.
+ Các kim loại khác nhau có khả năng dẫn điện khác nhau.
+ Những kim loại dẫn điện tốt là Ag, Cu, Au, Al,…
Thực tế, người ta chủ yếu sử dụng Cu và Al làm dây dẫn điện vì chúng dẫn điện tốt và có giá thành rẻ hơn so với Ag, Au.
3. Tính dẫn điện
- Kim loại có tính dẫn nhiệt
- Các kim loại khác nhau thường có khả năng dẫn nhiệt khác nhau. Kim loại nào dẫn điện tốt thường cũng dẫn nhiệt tốt.
- Do có tính dẫn nhiệt tốt nên một số kim loại được dùng để chế tạo dụng cụ nấu ăn.
4. Ánh kim
- Kim loại có ánh kim:
+ Khi quan sát các đồ trang sức bằng vàng hay bạc, ta thấy trên bề mặt của chúng có vẻ sáng lấp lánh gọi là ánh kim. Một số kim loại khác như nhôm, sắt,… cũng có ánh kim.
+ Do có ánh kim nên một số kim loại được dùng làm đồ trang sức và các vật dụng trang trí khác.
5. Một số tính chất vật lí khác của kim loại
- Kim loại còn cố một số tính chất vật lí khác như khối lượng riêng, nhiệt độ nóng chảy và tính cứng khác nhau.
a. Khối lượng riêng:
- Để biết kim loại này nặng hay nhẹ hơn so với kim loại khác, người ta so sánh giá trị khối lượng riêng của chúng.
Ví dụ: So sánh giá trị khối lượng riêng, ta biết được kim loại nhôm (D = 2,70 g/cm3) nhẹ hơn sắt (D = 7,86 g/cm3).
b. Nhiệt độ nóng chảy
- Nhiệt độ nóng chảy của một kim loại là nhiệt độ mà tại đó kim loại chuyển từ thể rắn sang thể lỏng.
Ví dụ: Nhiệt độ nóng chảy của nhôm là 660,3 oC,…
c. Tính cứng
- Các kim loại khác nhau có tính cứng khác nhau.
- Các kim loại mềm như K, Na,… có thể dùng dao cắt được. Kim loại cứng nhất là Cr (có thể cắt được kính).
II. TÍNH CHẤT HOÁ HỌC
1. Phản ứng của kim loại với phi kim
a. Tác dụng với oxygen
- Hầu hết kim loại phản ứng với oxygen tạo thành oxide.
Ví dụ:
b. Tác dụng với phi kim khác
- Ở nhiệt độ cao, các kim loại Fe, Mg, Cu,… phản ứng được với S cho sản phẩm là các muối sulfide FeS, MgS, CuS,....
Ví dụ:
- Nhiều kim loại phản ứng với khí chlorine (Cl2) tạo thành muối chloride.
Ví dụ:
2. Phản ứng của kim loại với dung dịch acid
-4
- Nhiều kim loại tác dụng với các dung dịch acid (HCl, H2SO4 loãng,…) tạo thành muối và giải phóng khí H2.
- Ví dụ: 2Al + 6HCl → 2AlCl3 + 3H2↑
- Một số kim loại như Cu, Ag, Au,… không tác dụng với dung dịch acid (HCl, H2SO4 loãng,…).
3. Phản ứng của kim loại với dung dịch muối
- Kim loại hoạt động hoá học mạnh hơn (trừ các kim loại K, Na, Ca,…) có thể đẩy được kim loại có mức độ hoạt động hoá học yếu hơn ra khỏi dung dịch muối, tạo thành muối mới và kim loại mới.
- Ví dụ: Fe + CuSO4 → FeSO4 + Cu
Fe đẩy được Cu ra khỏi dung dịch muối CuSO4. Ta nói Fe hoạt động hoá học mạnh hơn Cu.
4. Phản ứng với nước
- Một số kim loại như K, Na, Ca,… tác dụng với nước ở nhiệt độ thường tạo thành hydroxide và khí H2.
Ví dụ: 2Na + 2H2O → 2NaOH + H2↑
- Một số kim loại như Zn và Fe tác dụng được với hơi nước ở nhiệt độ cao tạo thành oxide và khí H2.
Ví dụ:
III. SỰ KHÁC BIỆT VỀ TÍNH CHẤT CỦA MỘT SỐ KIM LOẠI
Một số kim loại quen thuộc trong đời sống như nhôm, sắt, vàng,… có sự khác biệt về tính chất vật lí và tính chất hoá học. Do vậy, chúng được sử dụng với những mục đích khác nhau.
- Nhôm:
+ Là kim loại màu trắng bạc, khá mềm, dẫn nhiệt, dẫn điện tốt và nhẹ.
+ Nhôm tác dụng được với nhiều phi kim, nhiều dung dịch acid, dung dịch muối,… Tuy nhiên, nhôm bền trong môi trường không khí và nước do có lớp màng aluminium oxide (Al2O3) bền vững bảo vệ.
+ Nhôm thường được sử dụng làm dây dẫn điện và là nguyên liệu để sản xuất vật dụng như khung cửa, vách ngăn, khung máy,…
- Sắt:
+ Có màu trắng hơi xám, có tính dẻo, có độ cứng cao và có tính nhiễm từ.
+ Sắt tác dụng được với nhiều phi kim, nhiều dung dịch acid, muối và hơi nước ở nhiệt độ cao.
+ Có nhiều ứng dụng trong đời sống và sản xuất, là thành phần chủ yếu trong gang và thép.
- Vàng:
+ Có tính dẻo, tính dẫn điện và dẫn nhiệt rất tốt, có màu vàng, lấp lánh.
+ Vàng bền trong không khí, không bị hoà tan trong dung dịch HCl, H2SO4,…
+ Thường được sử dụng làm đồ trang sức, một số chi tiết của mạch điện tử,…
Xem thêm các chương trình khác:
- Soạn văn 9 Cánh diều (hay nhất)
- Văn mẫu 9 - Cánh diều
- Tóm tắt tác phẩm Ngữ văn 9 – Cánh diều
- Tác giả tác phẩm Ngữ văn 9 - Cánh diều
- Bố cục tác phẩm Ngữ văn 9 – Cánh diều
- Nội dung chính tác phẩm Ngữ văn 9 – Cánh diều
- Soạn văn 9 Cánh diều (ngắn nhất)
- Giải sgk Toán 9 – Cánh diều
- Lý thuyết Toán 9 – Cánh diều
- Giải sbt Toán 9 – Cánh diều
- Giải sgk Tiếng Anh 9 - ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh lớp 9 ilearn Smart World đầy đủ nhất
- Trọn bộ Ngữ pháp Tiếng Anh lớp 9 ilearn Smart World đầy đủ nhất
- Giải sbt Tiếng Anh 9 – iLearn Smart World
- Bài tập Tiếng Anh 9 iLearn Smart World theo Unit có đáp án
- Giải sgk Lịch sử 9 – Cánh diều
- Giải sbt Lịch sử 9 – Cánh diều
- Giải sgk Địa lí 9 – Cánh diều