Sách bài tập KHTN 9 Bài 17 (Cánh diều): Tách kim loại. Sử dụng hợp kim
Với giải sách bài tập Khoa học tự nhiên 9 Bài 17: Tách kim loại. Sử dụng hợp kim sách Cánh diều hay nhất, ngắn gọn sẽ giúp học sinh dễ dàng làm bài tập trong SBT KHTN 9 Bài 17.
Giải SBT KHTN 9 Bài 17: Tách kim loại. Sử dụng hợp kim
Bài 17.1 trang 50 Sách bài tập KHTN 9: Phát biểu nào sau đây về quá trình tách kim loại là đúng?
A. Là quá trình biến đổi khoáng vật trong quặng thành một hợp chất của kim loại. Sau đó, dùng các phương pháp thích hợp để tách được kim loại từ hợp chất đó.
B. Là quá trình dùng các phản ứng hoá học để tách được kim loại từ hợp chất của kim loại.
C. Sử dụng quá trình biến đổi vật lí để thu được hợp chất của kim loại từ khoáng vật. Sau đó dùng các phản ứng hoá học để tách được kim loại từ hợp chất của kim loại.
D. Là quá trình sử dụng phương pháp điện phân hoặc phương pháp nhiệt luyện hay phương pháp thuỷ luyện để tách được kim loại từ hợp chất của kim loại.
Lời giải:
Đáp án đúng là: A
Quá trình tách kim loại là quá trình biến đổi khoáng vật trong quặng thành một hợp chất của kim loại. Sau đó, dùng các phương pháp thích hợp để tách được kim loại từ hợp chất đó.
Bài 17.2 trang 51 Sách bài tập KHTN 9: Phát biểu nào sau đây về các phương pháp tách kim loại từ hợp chất của kim loại là không đúng?
A. Phương pháp điện phân nóng chảy thường được dùng để tách các kim loại có mức độ hoạt động hoá học mạnh như Na, Mg, Al,...
B. Phương pháp nhiệt luyện thường được dùng để tách các kim loại có mức độ hoạt động hoá học trung bình như Zn, Fe, Pb,...
C. Phương pháp thuỷ luyện thường được dùng để tách các kim loại có mức độ hoạt động hoá học yếu như Cu, Ag, Au,...
D. Các kim loại có độ hoạt động hoá học khác nhau đáng kể thường được tách ra khỏi hợp chất của chúng bằng phương pháp khác nhau.
Lời giải:
Đáp án đúng là: B
Do: Phương pháp nhiệt luyện thường được dùng để tách các kim loại có mức độ hoạt động hoá học trung bình và yếu.
Bài 17.3 trang 51 Sách bài tập KHTN 9: Phát biểu nào sau đây là không đúng khi nói về sodium chloride (NaCl) và phương pháp tách natri ra khỏi sodium chloride?
A. Vì natri có độ hoạt động hoá học mạnh nên hợp chất sodium chloride rất bền.
B. Cần điện phân sodium chloride nóng chảy theo phương trình hoá học sau để thu được natri:
2NaCl 2Na + Cl2↑
C. Có thể thực hiện phản ứng sau ở nhiệt độ cao để thu được Na:
NaCl + Zn
D. Sau khi thu được natri từ hợp chất, cần bảo quản natri bằng cách lập tức ngâm nó trong dầu hoả khan.
Lời giải:
Đáp án đúng là: C
Kim loại Na có mức độ hoạt động hoá học mạnh nên được điều chế bằng phương pháp điện phân nóng chảy hợp chất của nó.
Bài 17.4 trang 51 Sách bài tập KHTN 9: Phát biểu nào sau đây là không đúng khi nói về magnesium oxide (MgO), zinc oxide (ZnO), iron(III) oxide (Fe2O3) và phương pháp tách kim loại ra khỏi mỗi oxide.
A. Do Zn và Fe có độ hoạt động hoá học trung bình, Mg có độ hoạt động hoá học mạnh nên ZnO, Fe2O3 là các oxide kém bền hơn so với MgO.
B. Trong công nghiệp, việc tách Zn và Fe ra khỏi oxide theo phương trình hoá học sau:
ZnO + C Zn + CO (1)
Fe2O3 + 3CO 2Fe + 3CO2 (2)
C. Nếu thực hiện phản ứng: MgO + C Mg + CO (3)
thì dự đoán rằng phản ứng (3) sẽ tốn ít năng lượng hơn so với phản ứng (2).
D. (1) và (2) là phản ứng tách kim loại theo phương pháp nhiệt luyện.
Lời giải:
Đáp án đúng là: C
Do Zn và Fe có độ hoạt động hoá học trung bình, Mg có độ hoạt động hoá học mạnh nên ZnO, Fe2O3 là các oxide kém bền hơn so với MgO. Do đó, thực hiện phản ứng (3) sẽ tốn nhiều năng lượng hơn so với phản ứng (2).
Bài 17.5 trang 52 Sách bài tập KHTN 9: Phát biểu nào sau đây là không đúng về gang và thép?
A. Gang và thép đều là vật liệu kim loại tạo bởi kim loại cơ bản là sắt.
B. Gang được sử dụng phổ biến hơn thép.
C. Hàm lượng carbon trong thép nhỏ hơn hàm lượng carbon trong gang.
D. Gang và thép cứng hơn kim loại sắt.
Lời giải:
Đáp án đúng là: B
Do: thép được sử dụng phổ biến hơn gang.
Bài 17.6 trang 52 Sách bài tập KHTN 9: Ở Mĩ, người ta xử lí nước biển để thu được muối magnesium chloride (MgCl2). Dựa vào độ hoạt động hoá học của magnesium, đề xuất phương pháp tách Mg từ magnesium chloride. Viết phương trình hoá học của phản ứng xảy ra.
Lời giải:
Magnesium có độ hoạt động hoá học mạnh nên thường được tách ra khỏi hợp chất bằng phương pháp điện phân nóng chảy.
Phương trình hoá học của phản ứng xảy ra:
MgCl2 Mg + Cl2
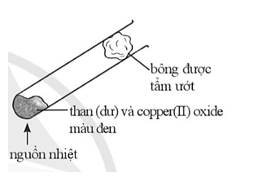
Bài 17.7 trang 52 Sách bài tập KHTN 9: Thực hiện thí nghiệm theo mô tả hình bên.
Nung nóng ống nghiệm một thời gian, để nguội thu được chất rắn có màu đen và màu nâu đỏ xen lẫn.
a) Viết phương trình hoá học của phản ứng diễn ra.
b) Dự đoán thành phần của hỗn hợp rắn trong ống nghiệm sau khi để nguội.
c) Gọi tên của phương pháp tách kim loại trên.
Lời giải:
a) Phương trình hoá học của phản ứng diễn ra:
C + CuO Cu + CO
b) Dự đoán thành phần của hỗn hợp rắn sau khi để nguội gồm: CuO còn dư (màu đen) và Cu tạo thành (màu nâu đỏ).
c) Phương pháp tách kim loại này là phương pháp nhiệt luyện.
Bài 17.8 trang 52 Sách bài tập KHTN 9: Hoà tan hoàn toàn 2,4 gam magnesium trong dung dịch hydrochloric acid dư.
a) Tính số mol khí hydrogen thu được.
b) Dẫn toàn bộ lượng khí hydrogen trên vào một ống thuỷ tinh nằm ngang chứa 8,0 gam bột CuO, đun nóng để thực hiện phản ứng điều chế Cu theo phương trình hoá học:
CuO + H2 Cu + H2O
Thực tế, chỉ có 75% lượng khí hydrogen phản ứng với CuO. Sau khi dừng phản ứng:
- Thu được hỗn hợp chất rắn A gồm các chất nào?
- Khối lượng chất rắn A là bao nhiêu gam?
c) Cần cho chất rắn A trong lượng dư của chất nào sau đây để thu được kim loại đồng: nước, dung dịch hydrochloric acid, dung dịch sodium hydroxide? Giải thích.
Lời giải:
a) Phương trình hoá học:
Mg + 2HCl → MgCl2 + H2
Theo phương trình hoá học ta có:
b)
Thực tế chỉ có 75% lượng khí hydrogen phản ứng nên số mol hydrogen phản ứng là:
Phương trình hoá học: CuO + H2 Cu + H2O
Theo phương trình hoá học ta có: nCuO phản ứng = nhydrogen phản ứng = 0,075 mol.
- Vậy chất rắn A gồm: CuO dư và Cu sinh ra.
- Ta có:
nCu sinh ra = nCuO phản ứng = 0,075 mol; nCuO dư = nCuO ban đầu – nCuO phản ứng = 0,025 mol.
Vậy khối lượng chất rắn A là: mA = mCu + mCuO dư = 0,075.64 + 0,025.80 = 6,8 gam.
c) Để thu được kim loại đồng cần cho hỗn hợp rắn A vào dung dịch hydrochloric acid (HCl). Khi đó, CuO phản ứng với HCl tạo thành muối tan, theo phương trình hoá học:
CuO + 2HCl → CuCl2 + H2O
Cu không phản ứng với HCl, lọc lấy phần chất rắn ta thu được kim loại đồng.
Bài 17.9 trang 52 Sách bài tập KHTN 9: Vật trang trí bằng đồng thường bị đen do lớp đồng bên ngoài phản ứng với oxygen không khí.
a) Người ta có thể dùng bông thấm dung dịch hydrochloric acid loãng chà lên các vết đen ấy. Vì sao? Viết các phương trình hoá học của phản ứng xảy ra.
b) Có thể thay dung dịch hydrochloric acid bằng giấm hoặc nước cốt chanh được không? Vì sao?
Lời giải:
Vật trang trí bằng đồng thường bị đen do lớp đồng bên ngoài phản ứng với oxygen không khí tạo thành oxide, theo phương trình hoá học:
2Cu + O2 2CuO
a) Người ta có thể dùng bông thấm dung dịch hydrochloric acid loãng (HCl) chà lên các vết đen ấy. Do CuO phản ứng với HCl tạo thành muối tan nên dễ bị rửa trôi, Cu không phản ứng với HCl nên không ảnh hưởng nhiều đến vật trang trí.
Phương trình hoá học: CuO + 2HCl → CuCl2 + H2O.
b) Có thể thay dung dịch hydrochloric acid bằng giấm hoặc nước cốt chanh. Do trong giấm ăn hoặc chanh đều có chứa acid, có thể phản ứng với CuO tạo thành muối tan dễ rửa trôi.
Bài 17.10 trang 53 Sách bài tập KHTN 9: Kim loại kẽm được tách từ quặng chứa khoáng vật sphalerite có thành phần chính là zinc sulfide (ZnS).
a) Viết các phương trình hoá học của quá trình tách kẽm từ zinc sulfide.
b) Trong quá trình tách kẽm từ zinc sulfide người ta thu được khí sulfur dioxide, khí này có thể được dùng để sản xuất sulfuric acid theo sơ đồ:
sulfur dioxide sulfur trioxide sulfuric acid
Viết các phương trình hoá học minh hoạ sơ đồ trên.
c) Sulfuric acid được cho phản ứng với hợp chất phù hợp để tạo ra một số phân bón hoá học. Viết phương trình hoá học của phản ứng tạo ra một phân bón SA (phân bón có thành phần chính là ammonium sulfate ((NH4)2SO4) từ phản ứng giữa sulfuric acid với ammonia (NH3).
Lời giải:
a) Phương trình hoá học của quá trình tách kẽm từ zinc sulfide.
ZnS + O2 ZnO + SO2
ZnO + C Zn + CO
b) Các phương trình hoá học minh hoạ sơ đồ:
2SO2 + O2 2SO3
SO3 + H2O → H2SO4
c) Phương trình hoá học tạo phân bón SA:
2NH3 + H2SO4 → (NH4)2SO4
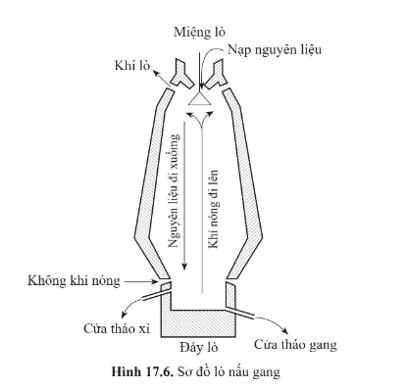
Bài 17.11 trang 53 Sách bài tập KHTN 9: Điền 10 thông tin phù hợp (từ (1) đến (10)) vào các chỗ trống trong đoạn mô tả gang và quá trình sản xuất gang dưới đây.
Gang là vật liệu kim loại tạo bởi kim loại cơ bản là ...(1)... cùng với khoảng ...(2)... % carbon theo khối lượng.
Nguyên liệu chính để sản xuất gang là quặng sắt, ...(3)... và đá vôi. Các nguyên liệu này được xếp thành từng lớp xen kẽ và được cho di chuyển chậm từ ...(4)... xuống đáy lò, tiếp xúc với luồng không khí nóng di ngược từ phía đáy lò lên. Các phản ứng hoá học chính diễn ra trong quá trình nguyên liệu di chuyển từ đỉnh lò xuống đáy lò là:
C + ...(5)... → CO2
CO2 + ...(6)... → CO
Fe2O3 + CO → ...(7)... + ...(8)....
Gần đáy lò, sắt ở trạng thái ...(9)... hoà tan một lượng nhỏ ...(10)... cùng một số nguyên tố khác như Mn, Si, P,... tạo thành gang lỏng, chảy xuống đáy lò và sau đó được dẫn ra ngoài qua cửa tháo gang.
Lời giải:
Gang là vật liệu kim loại tạo bởi kim loại cơ bản là (1) sắt cùng với khoảng (2) 2 - 5 % carbon theo khối lượng.
Nguyên liệu chính để sản xuất gang là quặng sắt, (3) than và đá vôi. Các nguyên liệu này được xếp thành từng lớp xen kẽ và được cho di chuyển chậm từ (4) đỉnh lò xuống đáy lò, tiếp xúc với luồng không khí nóng di ngược từ phía đáy lò lên. Các phản ứng hoá học chính diễn ra trong quá trình nguyên liệu di chuyển từ đỉnh lò xuống đáy lò là:
C + (5) O2 → CO2
CO2 + (6) C → 2CO
Fe2O3 + 3CO → (7) 2Fe + (8) 3CO2
Gần đáy lò, sắt ở trạng thái (9) nóng chảy hoà tan một lượng nhỏ (10) carbon cùng một số nguyên tố khác như Mn, Si, P,... tạo thành gang lỏng, chảy xuống đáy lò và sau đó được dẫn ra ngoài qua cửa tháo gang.
Bài 17.12 trang 53 Sách bài tập KHTN 9: Điền 5 thông tin phù hợp (từ (1) đến (5)) vào các chỗ trống trong đoạn mô tả thép và quá trình sản xuất thép dưới đây.
Thép là hợp kim phổ biến của nguyên tố ...(1)... với khoảng dưới ...(2)...% carbon và lượng nhỏ của một số kim loại khác.
Nguyên liệu để sản xuất thép thường là gang, sắt phế liệu và khí ...(3).... Khí này được sục vào lò chứa hỗn hợp gang và sắt phế liệu nóng chảy, phản ứng với một phần nguyên tố ...(4)... tạo thành khí ...(5)... thoát ra khỏi lò. Nhờ quá trình này, đã biến nguyên liệu ban đầu thành thép nóng chảy.
Lời giải:
Thép là hợp kim phổ biến của nguyên tố (1) sắt với khoảng dưới (2) 2 % carbon và lượng nhỏ của một số kim loại khác.
Nguyên liệu để sản xuất thép thường là gang, sắt phế liệu và khí (3) oxygen. Khí này được sục vào lò chứa hỗn hợp gang và sắt phế liệu nóng chảy, phản ứng với một phần nguyên tố (4) carbon tạo thành khí (5) CO2 thoát ra khỏi lò. Nhờ quá trình này, đã biến nguyên liệu ban đầu thành thép nóng chảy.
Bài 17.13 trang 53 Sách bài tập KHTN 9: Hãy tìm hiểu và cho biết thành phần cơ bản và tính chất quan trọng của hợp kim dùng để chế tạo:
a) Vỏ máy bay (lớp phủ của thân và cánh máy bay).
b) Dụng cụ phẫu thuật.
c) Mỏ neo của tàu biển.
Lời giải:
|
|
Thành phần cơ bản |
Tính chất quan trọng |
|
a) Vỏ máy bay (lớp phủ của thân và cánh máy bay). |
Hợp kim của nhôm (Al với Mg, Mn) |
Nhẹ, bền |
|
b) Dụng cụ phẫu thuật. |
Inox (hợp kim của Fe với C, Cr, Mo, Ni) |
Không gỉ, cứng, sáng bóng, chống mài mòn |
|
c) Mỏ neo của tàu biển. |
Thép (hợp kim của Fe với C, Mn, Ni, Cr) |
Khối lượng riêng lớn (nặng); bền trong môi trường nước sông, biển; khả năng chống mài mòn cao |
Lý thuyết KHTN 9 Bài 17: Tách kim loại. Sử dụng hợp kim
I. PHƯƠNG PHÁP TÁCH KIM LOẠI
- Từ quặng, người ta thường làm giàu quặng bằng cách loại bỏ tạp chất (đất, cát, đá,…) để thu được hợp chất của kim loại có hàm lượng cao. Sau đó, từ hợp chất của kim loại sẽ tách được kim loại ở dạng đơn chất bằng phương pháp thích hợp như phương pháp điện phân nóng chảy, phương pháp nhiệt luyện và phương pháp thuỷ luyện.
1. Phương pháp điện phân nóng chảy
- Thường dùng để tách các kim loại có mức độ hoạt động hoá học mạnh như Na, Mg, Al,…
Ví dụ: Từ quặng bauxite, tách được aluminium oxide (Al2O3). Điện phân nóng chảy Al2O3, tách được nhôm (aluminium – Al) ra khỏi oxide theo phương trình hoá học:
2. Phương pháp nhiệt luyện
- Thường được dùng để tách các kim loại có mức độ hoạt động hoá học trung bình và yếu như Fe, Zn, Cu…
- Ví dụ 1: Tách được sắt ra khỏi iron(III) oxide (Fe2O3):
- Ví dụ 2: Quặng sphalerite có thành phần chính là zinc sulfide (ZnS). Từ quặng sphalerite người ta tách kẽm như sau:
+ Nung quặng sphalerite trong không khí ở nhiệt độ cao thu được zinc oxide (ZnO):
+ Sau đó, cho zinc oxide phản ứng với carbon ở nhiệt độ cao, tách được kẽm:
3. Mở rộng về phương pháp thuỷ luyện
- Phương pháp thuỷ luyện để tách các kim loại có mức độ hoạt động hoá học yếu.
- Trước tiên, các đơn chất hoặc hợp chất của kim loại có mức độ hoạt động yếu có trong khoáng vật được chuyển thành muối tan. Sau đó dùng kim loại có mức độ hoạt động hoá học mạnh hơn để đẩy các kim loại có mức độ hoạt động hoá học yếu hơn ra khỏi dung dịch muối.
II. HỢP KIM
1. Khái niệm hợp kim
- Hợp kim là vật liệu kim loại có chứa kim loại cơ bản và kim loại khác hoặc phi kim.
- Ví dụ: Khi trộn đều, làm nguội hỗn hợp nóng chảy gồm nhôm và một lượng nhỏ đồng thu được hợp kim Al – Cu. Hợp kim này được gọi là hợp kim của nhôm do nhôm là kim loại cơ bản để tạo nên chúng.
2. Sử dụng hợp kim
- Một số hợp kim có nhiều tính chất ưu việt hơn so với kim loại tạo nên chúng, như tính cứng, độ bền cơ học, hoá học, khả năng chịu mài mòn,…
Ví dụ: Đồng thau (hợp kim của đồng và kẽm) cứng hơn, chịu ăn mòn tốt hơn đồng hoặc kẽm.
- Nhiều loại hợp kim của nhôm, của sắt, của đồng,… được sử dụng làm vật liệu xây dựng, vật liệu chế tạo máy móc, thiết bị, dụng cụ, đồ dùng,…
3. Một số hợp kim phổ biến
Hợp kim của sắt và hợp kim của nhôm được sử dụng phổ biến trong cuộc sống.
4. Sản xuất gang, thép
a. Sản xuất gang
- Nguyên liệu: quặng sắt (thường là quặng hematite), than cốc và chất tạo xỉ như CaCO3, SiO2,… Các nguyên liệu này được xếp thành từng lớp xen kẽ và được cho di chuyển chậm từ miệng lò xuống đáy lò, tiếp xúc với luồng không khí nóng đi ngược từ phía dưới đáy lò lên.
- Các giai đoạn cơ bản của quá trình sản xuất gang bao gồm:
+ Than bị cháy trong lò tạo khí carbon monoxide theo các phản ứng sau:
+ CO phản ứng với oxide của sắt và một số oxide tạp chất có trong nguyên liệu tạo ra Fe cùng với Mn, Si,…
Sắt nóng chảy hoà tan một lượng nhỏ carbon cùng một số nguyên tố khác như Mn, Si,… tạo thành gang lỏng, chảy xuống đáy lò và sau đó được dẫn ra ngoài qua cửa tháo gang. Hàm lượng carbon trong gang vào khoảng 2 – 5%.
+ Trong quá trình nung, đá vôi bị phân huỷ tạo thành calcium oxide (CaO):
CaO kết hợp với các tạp chất trong quặng tạo thành xỉ như:
Xỉ nhẹ nên nổi lên trên bề mặt gang lỏng, được tháo ra ngoài qua cửa tháo xỉ.
b. Sản xuất thép
- Nguyên liệu chính: Gang hoặc thép phế liệu và khí oxygen.
- Quá trình sản xuất thép: Khí oxygen được sục vào lò chứa gang hoặc thép phế liệu hoặc hỗn hợp gồm gang và thép phế liệu nóng chảy. Khí oxygen phản ứng với một phần các nguyên tố C, P, Si, Mn,… có trong nguyên liệu nóng chảy tạo thành một số hợp chất ở thế khí tự thoát ra khỏi lò và một số chất ở dạng xỉ được tháo ra khỏi lò. Sản phẩm còn lại trong lò là thép với thành phần chính là sắt và carbon, trong đó, hàm lượng của carbon nhỏ hơn 2%. Thép nóng chảy được chuyển sang khu vực đổ khuôn tạo hình và làm nguội.
Xem thêm các chương trình khác:
- Soạn văn 9 Cánh diều (hay nhất)
- Văn mẫu 9 - Cánh diều
- Tóm tắt tác phẩm Ngữ văn 9 – Cánh diều
- Tác giả tác phẩm Ngữ văn 9 - Cánh diều
- Bố cục tác phẩm Ngữ văn 9 – Cánh diều
- Nội dung chính tác phẩm Ngữ văn 9 – Cánh diều
- Soạn văn 9 Cánh diều (ngắn nhất)
- Giải sgk Toán 9 – Cánh diều
- Lý thuyết Toán 9 – Cánh diều
- Giải sbt Toán 9 – Cánh diều
- Giải sgk Tiếng Anh 9 - ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh lớp 9 ilearn Smart World đầy đủ nhất
- Trọn bộ Ngữ pháp Tiếng Anh lớp 9 ilearn Smart World đầy đủ nhất
- Giải sbt Tiếng Anh 9 – iLearn Smart World
- Bài tập Tiếng Anh 9 iLearn Smart World theo Unit có đáp án
- Giải sgk Lịch sử 9 – Cánh diều
- Giải sbt Lịch sử 9 – Cánh diều
- Giải sgk Địa lí 9 – Cánh diều