Lý thuyết Luyện tập tính chất của kim loại (mới 2024 + Bài Tập) - Hóa học 12
Tóm tắt lý thuyết Hóa 12 Bài 22: Luyện tập tính chất của kim loại ngắn gọn, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm Hóa 12 Bài 22.
Lý thuyết Hoá 12 Bài 22: Luyện tập tính chất của kim loại
Bài giảng Hoá 12 Bài 22: Luyện tập tính chất của kim loại
Kiến thức cần nắm vững
1. Cấu tạo của kim loại
a) Cấu tạo nguyên tử
Nguyên tử của hầu hết các nguyên tố kim loại có số electron lớp ngoài cùng ít (1, 2, 3e).
b) Cấu tạo tinh thể
Trong tinh thể kim loại, nguyên tử và ion kim loại nằm ở những nút mạng của tinh thể. Các electron hóa trị chuyển động tự do trong mạng tinh thể.
c) Liên kết kim loại
Liên kết kim loại là liên kết được hình thành giữa nguyên tử và ion kim loại trong mạng tinh thể do sự tham gia của các electron tự do.
2. Tính chất của kim loại
a) Tính chất vật lý chung
Các kim loại đều có tính dẻo, dẫn điện, dẫn nhiệt, có ánh kim do các electron tự do trong kim loại gây ra.
b) Tính chất hóa học
- Các kim loại đều có tính khử: M → Mn+ + ne
- Nguyên nhân: Các electron hóa trị của nguyên tử kim loại liên kết yếu với hạt nhân nguyên tử, do đó các kim loại có khả năng nhường electron để tạo thành ion dương.
3. Dãy điện hoá của kim loại
- Người ta đã so sánh tính chất của nhiều cặp oxi hóa – khử và sắp xếp thành dãy điện hóa của kim loại:

- Dãy điện hóa của kim loại cho phép dự đoán chiều của phản ứng giữa hai cặp oxi hóa – khử theo quy tắc alpha (α): Phản ứng giữa hai cặp oxi hóa – khử sẽ xảy ra theo chiều chất oxi hóa mạnh hơn sẽ oxi hóa chất khử mạnh hơn, sinh ra chất oxi hóa yếu hơn và chất khử yếu hơn.
- Cách xác định chiều của phản ứng oxi hóa – khử theo quy tắc alpha:
Tổng quát
Giả sử có hai cặp oxi hóa khử: Xx+/ X và Yy+/Y (trong đó cặp Xx+/ X đứng trước cặp Yy+/Y trong dãy điện hóa). Xác định chiều của phản ứng oxi hóa khử.
Bước 1: Viết hai cặp oxi hóa – khử theo đúng thứ tự trong dãy điện hóa:
Bước 2: Áp dụng quy tắc alpha (α)
Phản ứng xảy ra theo chiều mũi tên như sau:
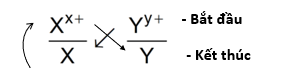
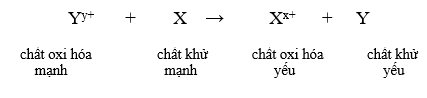
Bước 3: Xác định chiều phản ứng
Phản ứng xảy ra như sau:
Trắc nghiệm Hóa học 12 Bài 22: Luyện tập tính chất của kim loại
Câu 1: Nhóm kim loại không tác dụng được với dung dịch HNO3 đặc nguội là
A. Fe, Cr, Al.
B. Cr, Pb, Mn.
C. Al, Ag, Pb.
D. Ag, Pt, Au.
Hướng dẫn giải
Đáp án A
Một số kim loại như Fe, Cr, Al thụ động trong HNO3 đặc nguội và H2SO4 đặc nguội.
Câu 2: Kim loại có nhiệt độ nóng chảy thấp nhất là
A. vàng.
B. vonfram.
C. nhôm.
D. thủy ngân.
Hướng dẫn giải
Đáp án D
Kim loại tồn tại ở trạng thái rắn (trừ Hg). Hg có tonc = – 39oC
Câu 3: Vonfam (W) thường được dùng để chế tạo dây tóc bóng đèn. Nguyên nhân là do:
A. W là kim loại rất dẻo.
B. W là kim loại nhẹ và bền.
C. W có khả năng dẫn điện tốt.
D. W có nhiệt độ nóng chảy rất cao.
Hướng dẫn giải
Đáp án D
Vonfam (W) có nhiệt độ nóng chảy cao nhất trong các kim loại (3410oC) nên thường được dùng để chế tạo dây tóc bóng đèn
Câu 4: Trong các muối sau, muối nào dễ bị nhiệt phân?
A. LiCl.
B. NaNO3.
C. KHCO3.
D. KBr.
Hướng dẫn giải
Đáp án C
2KHCO3 K2CO3 + CO2 + H2O
Câu 5: Cho các phát biểu sau:
(1) Các oxit của kim loại kiềm phản ứng với CO tạo thành kim loại.
(2) Các kim loại Ag, Fe, Cu và Mg đều được điều chế bằng phương pháp điện phân dung dịch.
(3) Các kim loại Mg, K và Fe đều khử được ion Ag+ trong dung dịch thành Ag.
(4) Cho Cu vào dung dịch FeCl3 dư, thu được dung dịch chứa 3 muối. Số phát biểu đúng là
A. 4.
B. 1.
C. 3.
D. 2.
Đáp án B
Phát biểu đúng là (4)
Câu 6: Nhận xét nào về tính chất vật lí của kim loại dưới đây là không đúng ?
A. Nhiệt độ nóng chảy: Hg < Al < W.
B. Tính cứng: Cs < Fe < W < Cr
C. Tính dẫn điện và nhiệt: Fe < Al < Au < Cu < Ag.
D. Tính dẻo: Al < Au < Ag.
Hướng dẫn giải
Đáp án D
D sai vì Tính dẻo Al < Ag < Au
Câu 7: Cho 0,78 gam kim loại kiềm M tác dụng với nước (dư), thu được 0,01 mol khí H2. Kim loại M là
A. Na.
B. K.
C. Rb.
D. Li.
Hướng dẫn giải
Đáp án B
Kim loại kiềm có số electron nhường bằng 1
Bảo toàn electron:
1.nM = 2.
→ nM = 2.0,01 = 0,02 mol
MM = = 39 (g/mol) (K)
Câu 8: Cho các kim loại: Cu, Fe, Ag và các đung dịch HCl, CuSO4, FeCl2, FeCl3. Số cặp chất có phản ứng với nhau là
A. 2.
B. 3.
C. 4.
D. 5.
Hướng dẫn giải
Đáp án C
Các cặp chất xảy ra phản ứng là: Fe và HCl; Fe và CuSO4; Fe và FeCl3; Cu và FeCl3.
Fe + 2HCl → FeCl2 + H2
Fe + CuSO4 → FeSO4 + Cu
Fe + 2FeCl3 → 3FeCl2
Cu + 2FeCl3 → CuCl2 + 2FeCl2
Câu 9: Tính chất nào sau đây không phải là tính chất đặc trưng của kim loại?
A. Tác dụng với dung dịch muối.
B. Tác dụng với bazơ.
C. Tác dụng với phi kim.
D. Tác dụng với axit.
Hướng dẫn giải
Đáp án B
Chỉ một số kim loại như Al, Zn,... tác dụng được với bazơ
Câu 10: Cho hỗn hợp bột Al và Zn vào dung dịch chứa Cu(NO3)2 và AgNO3 sau phản ứng thu được dung dịch A gồm hai muối và hai kim loại. Hai muối trong dung dịch A là
A. Zn(NO3)2 và AgNO3.
B. A1(NO3)3 và Cu(NO3)2.
C. A1(NO3)3 và Zn(NO3)2.
D. A1(NO3)3 và AgNO3.
Hướng dẫn giải
Đáp án C
Kim loại nào có tính khử yếu nhất sẽ bị đẩy ra trước
Hai kim loại thu được là: Ag và Cu
Hai muối trong dung dịch A là: A1(NO3)3 và Zn(NO3)2
Xem thêm các bài tổng hợp lý thuyết Hóa học lớp 12 đầy đủ, chi tiết khác:
Lý thuyết Bài 23: Luyện tập Điều chế kim loại và sự ăn mòn kim loại
Lý thuyết Bài 3: Khái niệm về xà phòng và chất giặt rửa tổng hợp
Xem thêm các chương trình khác:
- Giải sgk Toán 12 (sách mới) | Giải bài tập Toán 12 Tập 1, Tập 2
- Các dạng bài tập Toán lớp 12
- Lý thuyết Toán 12
- Chuyên đề Toán lớp 12 mới nhất
- Bài tập Toán lớp 12 mới nhất
- Giáo án Toán lớp 12 mới nhất
- Tóm tắt tác phẩm Ngữ văn 12
- Soạn văn 12 (hay nhất) | Để học tốt Ngữ văn 12 (sách mới)
- Soạn văn 12 (ngắn nhất)
- Tác giả tác phẩm Ngữ văn lớp 12
- Văn mẫu lớp 12
- Giải sgk Sinh học 12 (sách mới) | Giải bài tập Sinh học 12
- Lý thuyết Sinh học 12 | Kiến thức trọng tâm Sinh 12
- Giải sgk Địa Lí 12 (sách mới) | Giải bài tập Địa lí 12
- Lý thuyết Địa Lí 12
- Giải Tập bản đồ Địa Lí 12
- Giải sgk Vật Lí 12 (sách mới) | Giải bài tập Vật lí 12
- Giải sbt Vật Lí 12
- Lý thuyết Vật Lí 12
- Các dạng bài tập Vật lí lớp 12
- Giáo án Vật lí lớp 12 mới nhất
- Giải sgk Lịch sử 12 (sách mới) | Giải bài tập Lịch sử 12
- Giải Tập bản đồ Lịch sử 12
- Lý thuyết Lịch sử 12
- Giải sgk Giáo dục công dân 12
- Lý thuyết Giáo dục công dân 12
- Giải sgk Giáo dục quốc phòng - an ninh 12 (sách mới) | Giải bài tập GDQP 12
- Lý thuyết Giáo dục quốc phòng 12 | Kiến thức trọng tâm GDQP 12
- Lý thuyết Tin học 12
- Lý thuyết Công nghệ 12
