Lý thuyết Amin (mới 2024 + Bài Tập) - Hóa học 12
Tóm tắt lý thuyết Hóa 12 Bài 9: Amin ngắn gọn, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm Hóa 12 Bài 9.
Lý thuyết Hoá 12 Bài 9: Amin
Bài giảng Hoá 12 Bài 9: Amin
I. Khái niệm, phân loại và danh pháp
1. Khái niệm
- Khi thay thế nguyên tử hiđro trong phân tử NH3 bằng gốc hiđrocacbon ta thu được amin.
- Ví dụ:
CH3–NH2; CH3–NH–CH3; ; CH2=CH–CH2NH2; C6H5NH2
2. Phân loại
Amin được phân loại theo hai cách thông dụng nhất:
a) Theo gốc hiđrocacbon
– Amin mạch hở: CH3NH2, C2H5NH2, ...
– Amin thơm: C6H5NH2, CH3C6H4NH2, ...
– Amin dị vòng : ;…
;…
b) Theo bậc amin
– Bậc amin thường được tính bằng số gốc hiđrocacbon liên kết với nguyên tử nitơ.
Theo đó, các amin được phân loại thành:
|
Amin bậc I |
Amin bậc II |
Amin bậc III |
|
R–NH2 |
R–NH–R’ |
|
|
R, R’ và R’’ là gốc hiđrocacbon |
||
- Ví dụ: amin bậc I: CH3CH2CH2NH2
amin bậc II: CH3CH2NHCH3
amin bậc III:
3. Đồng phân
Amin thường có đồng phân về:
– Mạch cacbon.
– Vị trí nhóm chức.
– Bậc của amin.
Ví dụ: Ứng với công thức phân tử C3H9N có các đồng phân:
CH3 – CH2 – CH2 – NH2
CH3 – CH (NH2) – CH3
CH3 – NH – CH2 – CH3
4. Danh pháp
Tên của các amin thường được gọi theo tên gốc – chức (gốc hiđrocacbon với chức amin) và tên thay thế.
a) Tên pháp gốc – chức = Tên gốc hiđrocacbon + amin
Ví dụ : CH3NH2 (Metylamin), C2H5–NH2 (Etylamin), CH3CH(NH2)CH3 (Isopropylamin), ….
b) Tên thay thế = Tên hiđrocacbon + vị trí + amin
Ví dụ : CH3NH2 (Metanamin), C2H5–NH2 (Etanamin), CH3CH(NH2)CH3 (Propan - 2 - amin), ...
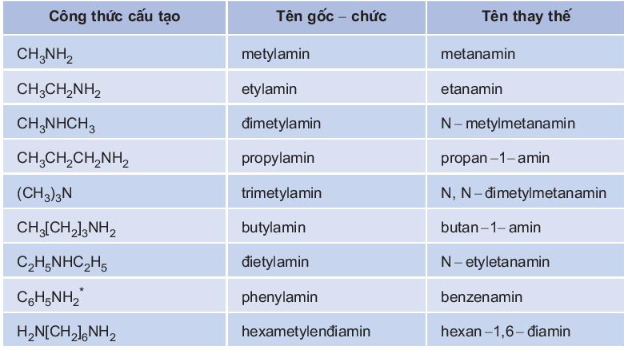
Tên gọi của một số amin
Lưu ý:
– Tên các nhóm ankyl đọc theo thứ tự chữ cái a, b, c, … + amin.
– Với các amin bậc 2 và 3, chọn mạch dài nhất chứa N làm mạch chính:
+ Có 2 nhóm ankyl → thêm 1 chữ N ở đầu.
Ví dụ : CH3–NH–C2H5 : N–metyletanamin.
+ Có 3 nhóm ankyl → thêm 2 chữ N ở đầu (nếu trong 3 nhóm thế có 2 nhóm giống nhau).
Ví dụ : CH3–N(CH3)–C2H5 : N, N–đimetyletanamin.
+ Có 3 nhóm ankyl khác nhau → 2 chữ N cách nhau 1 tên ankyl.
Ví dụ : CH3–N(C2H5 )–C3H7 : N–etyl–N–metylpropanamin.
– Khi nhóm –NH2 đóng vai trò nhóm thế thì gọi là nhóm amino.
Ví dụ : CH3CH(NH2)COOH (axit 2–aminopropanoic).
II. Tính chất vật lý
– Metylamin, đimetylamin, trimetylamin và etylamin là những chất khí có mùi khai khó chịu, tan nhiều trong nước.
- Các amin có phân tử khối cao hơn là những chất lỏng hoặc rắn, nhiệt độ sôi tăng dần và độ tan trong nước giảm dần theo chiều tăng của phân tử khối.
- Các amin thơm là chất lỏng hoặc rắn và dễ bị oxi hóa. Khi để trong không khí các amin thơm bị chuyển từ không màu thành màu đen vì bị oxi hóa.
- Các amin đều độc.

Cây thuốc lá chứa amin rất độc: nicotin
III. Cấu tạo phân tử và tính chất hóa học
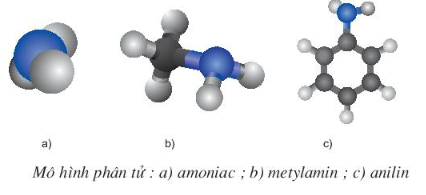
1. Cấu tạo phân tử
- Trong phân tử amin, nguyên tử nitơ còn một cặp electron tự do chưa liên kết có thể tạo liên kết cho – nhận giống NH3.
Vì vậy các amin có tính bazơ tương tự NH3.
- Ngoài ra, nguyên tử N trong amin có số oxi hóa -3 như trong NH3 nên amin thường dễ bị oxi hóa. Các amin thơm dễ tham gia phản ứng thế vào nhân thơm do ảnh hưởng của đôi electron chưa tham gia liên kết ở nguyên tử nitơ.
2. Tính chất hoá học
a) Tính bazơ
- Các amin tan nhiều trong nước như metylamin, etylamin … có khả năng làm xanh giấy quỳ tím hoặc hồng phenolphtalein, có lực bazơ mạnh hơn NH3 nhờ ảnh hưởng của nhóm ankyl.
- Anilin có tính bazơ, nhưng dung dịch của nó không làm xanh giấy quỳ tím cũng không làm hồng phenolphtalein vì lực bazơ của nó yếu và yếu hơn NH3. Đó là do ảnh hưởng của gốc phenyl (tương tự phenol).
- Ta có thể so sánh lực bazơ như sau:
CH3 – NH2 > NH3 > C6H5 – NH2
- Tác dụng với axit: R–NH2 + HCl → R–NH3Cl
Ví dụ:
CH3NH2 + HCl → CH3NH3Cl
- Tác dụng dung dịch muối của các kim loại có hiđroxit kết tủa
Ví dụ :
3CH3NH2 + FeCl3 + 3H2O → Fe(OH)3↓ + 3CH3NH3Cl
Lưu ý : Khi cho muối của Cu2+, Zn2+, … vào dung dịch amin (dư) hiđroxit kết tủa kết tủa tan (tạo phức chất).
b) Phản ứng thế ở nhân thơm của anilin
Do ảnh hưởng của nhóm NH2 (tương tự nhóm –OH ở phenol), ba nguyên tử H ở các vị trí ortho và para so với nhóm –NH2 trong nhân thơm của anilin bị thay thế bởi ba nguyên tử brom: :
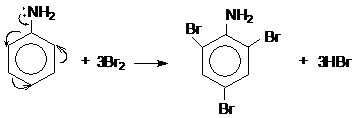
2, 4, 6 tribromanilin
Lưu ý: Phản ứng tạo ra kết tủa trắng 2, 4, 6 tribromanilin dùng nhận biết anilin
c) Phản ứng với axit nitrơ HNO2
- Amin bậc một tác dụng với axit nitrơ ở nhiệt độ thường cho ancol hoặc phenol và giải phóng nitơ. Ví dụ:
C2H5NH2 + HONO ® C2H5OH + N2 ↑ + H2O
- Anilin và các amin thơm bậc một tác dụng với axit nitrơ ở nhiệt độ thấp (0 - 5oC) cho muối điazoni :
C6H5NH2 + HONO + HCl C6H5N2+Cl- + 2H2O
phenylđiazoni clorua
d) Phản ứng cháy của amin no đơn chức mạch hở
Ví dụ:
V. Ứng dụng và điều chế
1. Ứng dung
Các ankylamin được dùng trong tổng hợp hữu cơ, đặc biệt là các điamin được dùng để tổng hợp polime.
Anilin là nguyên liệu quan trọng trong công nghiệp phẩm nhuộm, polime (nhựa anilin - fomanđehit,…), dược phẩm …
2. Điều chế
- Thay thế nguyên tử H của phân tử amoniac
NH3 CH3NH2 (CH3)2NH (CH3)3N
- Khử hợp chất nitro
C6H5NO2 + 6H C6H5NH2 + 2H2O
Trắc nghiệm Hóa học 12 Bài 9: Amin
Bài 1: Dung dịch chất nào sau đây làm quỳ tím chuyển sang màu xanh?
A. Glyxin.
B. Metylamin.
C. Anilin.
D. Glucozơ.
Bài 2: Amin no, đơn chức, mạch hở có công thức tổng quát là
A. CnH2nN.
B. CnH2n+1N.
C. CnH2n+3N.
D. CnH2n+2N.
Bài 3: Đốt cháy hoàn toàn m gam amin X (no, đơn chức, mạch hở) thu được CO2, H2O và 2,24 lít khí N2. Cho m gam X tác dụng hết với dung dịch HCl dư, số mol HCl đã phản ứng là
A. 0,1 mol.
B. 0,2 mol.
C. 0,3 mol.
D. 0,4 mol.
Bài 4: Hỗn hợp E gồm hai amin X (CnHmN), Y (CnHm+1N2, với n ≥ 2) và hai anken đồng đẳng kế tiếp. Đốt cháy hoàn toàn 0,08 mol E, thu được 0,03 mol N2, 0,22 mol CO2 và 0,30 mol H2O. Phần trăm khối lượng của X trong E là
A. 43,38%.
B. 57,84%.
C. 18,14%.
D. 14,46%
Bài 5: Ở điều kiện thường, amin X là chất lỏng, dễ bị oxi hoá khi để ngoài không khí. Dung dịch X không làm đổi màu quỳ tím nhưng tác dụng với nước brom tạo kết tủa trắng. Amin nào sau đây thoả mãn tính chất của X?
A. đimetylamin
B. benzylamin
C. metylamin
D. anilin
Bài 6: Cho 5,9 gam amin đơn chức X tác dụng vừa đủ với dung dịch HC1, tạo ra 9,55 gam muối, số công thức cấu tạo ứng với công thức phân tử của X là
A. 5.
B. 4.
C. 3.
D. 2.
Bài 7: Amin là hợp chất khi thay thế một hay nhiều nguyên tử hiđro trong phân tử NH3
A. bằng một hay nhiều gốc NH2
B. bằng một hay nhiều gốc hiđrocacbon.
C. bằng một hay nhiều gốc Cl.
D. bằng một hay nhiều gốc ankyl.
Bài 8: Khi đốt cháy hoàn toàn một amin đơn chức X, thu được 1,344 lít khí CO2,
0,224 lít khí N2 (các thể tích khí đo ở đktc) và 1,62 gam H2O. Công thức của X là
A. C4H9N.
B. C3H7N.
C. C2H7N.
D. C3H9N.
Bài 9: Cho 10 gam hỗn hợp 2 amin no đơn chức, mạch hở tác dụng vừa đủ với V ml dung dịch HC1 1M, thu được dung dịch chứa 15,84 gam hỗn hợp muối. Giá trị của V là
A. 80.
B. 320.
C. 200.
D. 160.
Bài 10: Một amin đơn chức bậc một có 23,73% nitơ về khối lượng, số đồng phân cấu tạo có thể có của amin này là
A. 2.
B. 3.
C. 4.
D. 1.
Xem thêm các bài tổng hợp lý thuyết Hóa học lớp 12 đầy đủ, chi tiết khác:
Lý thuyết Bài 11: Peptit và protein
Xem thêm các chương trình khác:
- Giải sgk Toán 12 (sách mới) | Giải bài tập Toán 12 Tập 1, Tập 2
- Các dạng bài tập Toán lớp 12
- Lý thuyết Toán 12
- Chuyên đề Toán lớp 12 mới nhất
- Bài tập Toán lớp 12 mới nhất
- Giáo án Toán lớp 12 mới nhất
- Tóm tắt tác phẩm Ngữ văn 12
- Soạn văn 12 (hay nhất) | Để học tốt Ngữ văn 12 (sách mới)
- Soạn văn 12 (ngắn nhất)
- Tác giả tác phẩm Ngữ văn lớp 12
- Văn mẫu lớp 12
- Giải sgk Sinh học 12 (sách mới) | Giải bài tập Sinh học 12
- Lý thuyết Sinh học 12 | Kiến thức trọng tâm Sinh 12
- Giải sgk Địa Lí 12 (sách mới) | Giải bài tập Địa lí 12
- Lý thuyết Địa Lí 12
- Giải Tập bản đồ Địa Lí 12
- Giải sgk Vật Lí 12 (sách mới) | Giải bài tập Vật lí 12
- Giải sbt Vật Lí 12
- Lý thuyết Vật Lí 12
- Các dạng bài tập Vật lí lớp 12
- Giáo án Vật lí lớp 12 mới nhất
- Giải sgk Lịch sử 12 (sách mới) | Giải bài tập Lịch sử 12
- Giải Tập bản đồ Lịch sử 12
- Lý thuyết Lịch sử 12
- Giải sgk Giáo dục công dân 12
- Lý thuyết Giáo dục công dân 12
- Giải sgk Giáo dục quốc phòng - an ninh 12 (sách mới) | Giải bài tập GDQP 12
- Lý thuyết Giáo dục quốc phòng 12 | Kiến thức trọng tâm GDQP 12
- Lý thuyết Tin học 12
- Lý thuyết Công nghệ 12
