Giải Khoa học tự nhiên 7 Bài 7 (Kết nối tri thức): Hóa trị và công thức hóa học
Với lời giải bài tập Khoa học tự nhiên lớp 7 Bài 7: Hóa trị và công thức hóa học sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi và làm bài tập KHTN 7 Bài 7.
Giải bài tập Khoa học tự nhiên 7 Bài 7: Hóa trị và công thức hóa học
Video giải Khoa học tự nhiên 7 Bài 7: Hóa trị và công thức hóa học
A/ Câu hỏi đầu bài
Lời giải:
- Trong công thức hóa học của hợp chất hai nguyên tố, tích của chỉ số và hóa trị của nguyên tố này bằng tích của chỉ số và hóa trị của nguyên tố kia.
- Người ta quy ước nguyên tố H luôn có hóa trị I. Nguyên tử của nguyên tố khác liên kết được với bao nhiêu nguyên tử H thì nguyên tố đó có hóa trị bằng bất nhiêu.
- Oxygen cũng được quy ước có hóa trị II. Từ đó ta xác định được hóa trị cho các nguyên tố khác trong các hợp chất có chứa H hoặc O.
B/ Câu hỏi giữa bài
I. Công thức hóa học
Lời giải:
Trong một phân tử copper sulfate (CuSO4) có một nguyên tử Cu, một nguyên tử S và bốn nguyên tử O.
Khối lượng phân tử CuSO4 bằng: 64.1 + 32.1 + 16.4 = 160 (amu)
Phần trăm khối lượng các nguyên tố trong CuSO4 là:
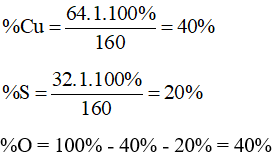
II. Hóa trị
1. Cách xác định hóa trị
Xác định hóa trị của chlorine trong hợp chất trên.
Lời giải:
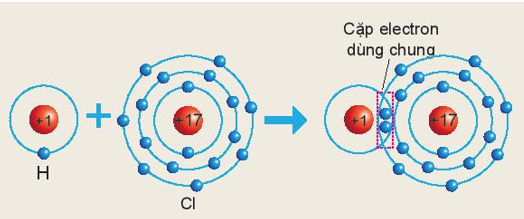
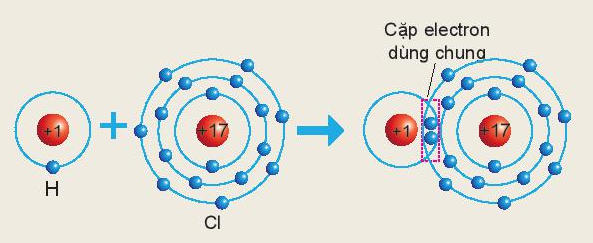
Trong chất cộng hóa trị, hóa trị của nguyên tố được xác định bằng số cặp electron dùng chung của nguyên tử nguyên tố đó với nguyên tử khác.
Theo sơ đồ mô tả sự hình thành liên kết cộng hóa trị trong phân tử HCl ta thấy:
Nguyên tử Cl có 1 cặp electron dùng chung với nguyên tử H ⇒ Trong hợp chất trên Cl có hóa trị I.
2. Quy tắc hóa trị
Hoạt động trang 42 Khoa học tự nhiên 7: Tìm hiểu về quy tắc hóa trị
Quan sát Bảng 7.1 và thực hiện các yêu cầu sau:
Lời giải:
1. Xét phân tử H2S
Ta thấy: 1.II = 2.I
⇒ Tích của chỉ số và hóa trị của nguyên tố lưu huỳnh bằng tích của chỉ số và hóa trị của nguyên tố hydrogen.
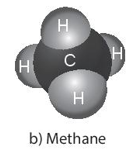
2. Xét phân tử CH4.
Ta thấy: 1.IV = 4.I
⇒ Tích của chỉ số và hóa trị của nguyên tố carbon bằng tích của chỉ số và hóa trị của nguyên tố hydrogen.
Lời giải:
Oxygen được quy ước có hóa trị II.
Hợp chất sulfur dioxide (SO2), nguyên tử nguyên tố S liên kết được với hai nguyên tử O nên có hóa trị IV
Lời giải:
Quy ước nguyên tố H có hóa trị I.
Nguyên tử C liên kết được với 4 nguyên tử H nên nguyên tử C có hóa trị IV.
Lời giải:
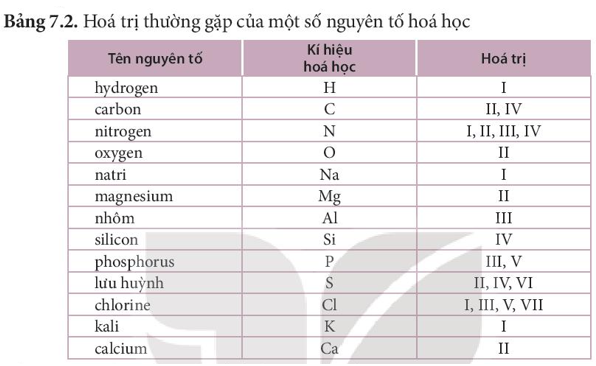
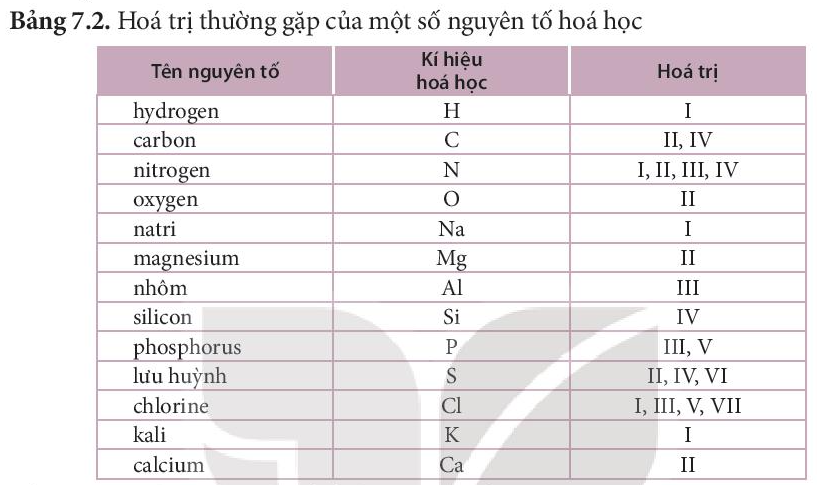
Theo bảng 7.2, nguyên tố K có hóa trị I, nguyên tố O có hóa trị II.
Giả sử, công thức hóa học của potassium oxide là KO.
Theo quy tắc hóa trị: 1.I ≠ 1.II
⇒ Giả sử sai.
⇒ Công thức hóa học của potassium oxide là K2O
Theo quy tắc hóa trị: 2.I = 1.II (thỏa mãn).
III. Lập công thức hóa học của hợp chất
2. Lập công thức hóa học của hợp chất theo phần trăm các nguyên tố
Lời giải:
Đặt công thức của khí carbon dioxide là CxOy.
Khối lượng phân tử của khí carbon dioxide là: 12.x + 16.y = 44
Ta có:
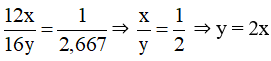
Thay y = 2x vào phương trình khối lượng phân tử được:
12.x + 16.2x = 44 ⇒ x = 1, vậy y = 2.
Vậy công thức của khí carbon dioxide là CO2.
Lời giải:
Đặt công thức của khí hydrogen sulfide là
Theo quy tắc hóa trị: x.I = y.II
⇒
Lấy x = 2 và y = 1.
Vậy công thức của khí hydrogen sulfide là H2S.
⇒ Khối lượng phân tử của khí hydrogen sulfide là: 2.1 + 32 = 34 (amu).
Phần trăm về khối lượng của lưu huỳnh và của hydrogen trong H2S là:
Lời giải:
Bột thuốc muối chữa đau dạ dày có công thức hóa học là NaHCO3 (natri hydrocarbonat hay sodium hydrocarbonate).

Khối lượng phân tử NaHCO3 bằng 23.1 + 1.1 + 12 + 16.3 = 84 amu
Phần trăm khối lượng các nguyên tố hóa học trong NaHCO3 là:
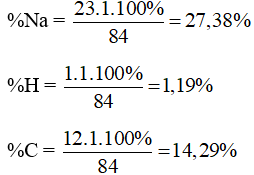
%O = 100% - 27,38% - 1,19% - 14,29% = 57,14%
Bài giảng Khoa học tự nhiên lớp 7 Kết nối tri thức
Lý thuyết Khoa học tự nhiên 7 Bài 7: Hóa trị và công thức hóa học
I. Công thức hóa học
1. Khái niệm
- Công thức hóa học của một chất là cách biểu diễn chất bằng kí hiệu hóa học của nguyên tố kèm theo chỉ số ở chân bên phải của kí hiệu hóa học.
Ví dụ: Công thức hóa học của oxygen là O2; công thức hóa học của carbon dioxide là CO2.
2. Cách viết công thức hóa học
a) Công thức hóa học của đơn chất
- Đối với các đơn chất được tạo thành từ nguyên tố kim loại, khí hiếm và một số phi kim thì kí hiệu hóa học của nguyên tố được coi là công thức hóa học.
Ví dụ: Công thức hóa học của đồng là Cu, sắt là Fe, helium là He, carbon là C, lưu huỳnh là S, …
- Một số phi kim có phân tử gồm hai hay ba nguyên tử liên kết với nhau thì thêm chỉ số này ở chân bên phải kí hiệu hóa học.
Ví dụ: Công thức hóa học của hydrogen là H2; oxygen là O2; ozone là O3…
b) Công thức hóa học của hợp chất:
- Công thức hóa học của hợp chất gồm kí hiệu hóa học của những nguyên tố tạo ra hợp chất kèm theo chỉ số ở chân bên phải kí hiệu hóa học.
- Chỉ số là những số nguyên, cho biết số nguyên tử của mỗi nguyên tố trong hợp chất, chỉ số bằng 1 thì không ghi.
Ví dụ: Công thức hóa học của khí methane là CH4, của muối ăn là NaCl.
3. Ý nghĩa của công thức hóa học
- Công thức hóa học cho biết:
+ Các nguyên tố hóa học tạo nên chất.
+ Số nguyên tử hay tỉ lệ số nguyên tử của các nguyên tố hóa học có trong phân tử.
+ Khối lượng phân tử của chất.
Ví dụ: Công thức hóa học của calcium carbonate CaCO3 cho biết:
+ Calcium carbonate gồm 3 nguyên tố là Ca, C và O.
+ Trong một phân tử calcium carbonate có một nguyên tử Ca, một nguyên tử C, ba nguyên tử O và tỉ lệ số nguyên tử Ca : C : O là 1 : 1 : 3.
+ Khối lượng phân tử bằng 40 + 12 + 3.16 = 100 amu.
- Biết công thức hóa học tính được phần trăm khối lượng của các nguyên tố trong hợp chất.
Bước 1: Tính khối lượng phân tử hợp chất.
Bước 2: Tính phần trăm khối lượng các nguyên tố trong hợp chất:

Ví dụ: Tính phần trăm khối lượng của các nguyên tố trong phân bón KNO3
Trong một phân tử KNO3 có một nguyên tử K, một nguyên tử N và ba nguyên tử O.
- Khối lượng phân tử KNO3 bằng: 39.1 + 14.1 + 16.3 = 101 (amu)
Phần trăm khối lượng các nguyên tố trong KNO3 là:
%O = 100% - 38,6% - 13,9% = 47,5%
II. Hóa trị
1. Khái niệm hóa trị
- Hóa trị là con số biểu thị khả năng liên kết của nguyên tử nguyên tố này với nguyên tử nguyên tố khác.
- Trong hợp chất cộng hóa trị, hóa trị của nguyên tố được xác định bằng số cặp electron dùng chung của nguyên tử nguyên tố đó với nguyên tử nguyên tố khác.
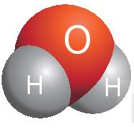
Ví dụ 1: Trong phân tử nước, mỗi nguyên tử H có một cặp electron dùng chung với nguyên tử O nên H có hóa trị I; nguyên tử O có hai cặp electron dùng chung với hai nguyên tử H nên O có hóa trị II.
Ví dụ 2: Phân tử HCl gồm 1 nguyên tử Cl liên kết với 1 nguyên tử H. Trong đó nguyên tử Cl có 1 cặp electron dùng chung với nguyên tử H
⇒ Nguyên tử H và Cl đều có hóa trị I
2. Quy tắc hóa trị
- Quy tắc hóa trị: Trong công thức hóa học của hợp chất hai nguyên tố, tích của chỉ số và hóa trị của nguyên tố này bằng tích của chỉ số và hóa trị của nguyên tố kia.
Ví dụ 1: áp dụng quy tắc hóa trị ta có: 2.V = 5.II
Ví dụ 2: áp dụng quy tắc hóa trị ta có: 1.IV = 4.I
- Quy tắc hóa trị được vận dụng chủ yếu cho các hợp chất vô cơ.
- Người ta quy ước nguyên tố H luôn có hóa trị I. Nguyên tử của nguyên tố khác liên kết được với bao nhiêu nguyên tử H thì có hóa trị là bấy nhiêu.
- Oxygen được quy ước có hóa trị II. Từ đó xác định được hóa trị của các nguyên tố khác trong hợp chất có chứa H hoặc O.
Ví dụ 1: Trong hợp chất HCl, 1 Cl liên kết với 1 H nên Cl có hóa trị I.
Ví dụ 2: Trong phân tử carbon dioxide (CO2), nguyên tử của nguyên tố C liên kết được với hai nguyên tử O nên có hóa trị IV.
- Hóa trị của nhóm nguyên tử được xác định tương tự như cách xác định hóa trị của nguyên tố.
Ví dụ: Trong phân tử sulfuric acid (H2SO4), nhóm (SO4) liên kết với 2 nguyên tử hydrogen nên có hóa trị II.

III. Lập công thức hóa học của hợp chất
1. Lập công thức hóa học của hợp chất khi biết hóa trị
- Các bước xác định:
+ Bước 1: Đặt công thức hóa học cần tìm (công thức tổng quát)
+ Bước 2: Lập biểu thức tính dựa vào quy tắc hóa trị, chuyển thành tỉ lệ các chỉ số nguyên tử.
+ Bước 3: Xác định số nguyên tử (những số nguyên đơn giản nhất, có tỉ lệ tối giản) và viết công thức hóa học cần tìm.
Ví dụ: Lập công thức hóa học của hợp chất tạo bởi lưu huỳnh có hóa trị IV và oxygen
Hướng dẫn:
Bước 1: Đặt công thức hóa học của hợp chất là:
Bước 2: Theo quy tắc hóa trị: x.IV = y.II
⇒
Bước 3: Chọn x = 1 và y = 2.
Vậy công thức hóa học của hợp chất là SO2
2. Lập công thức hóa học của hợp chất theo phần trăm các nguyên tố
Các bước xác định:
Bước 1: Đặt công thức hóa học cần tìm (công thức tổng quát);
Bước 2: Tính khối lượng phân tử của hợp chất
Bước 3: Lập biểu thức tính phần trăm nguyên tố có trong hợp chất. Xác định số nguyên tử của mỗi nguyên tố và viết công thức hóa học cần tìm.
Ví dụ 1: Lập công thức hóa học của hợp chất tạo bởi carbon và hydrogen, biết phần trăm khối lượng của C, H lần lượt là 75%, 25% và khối lượng phân tử của hợp chất là 16 amu.
Hướng dẫn
Bước 1: Đặt công thức của hợp chất là: CxHy
Bước 2: Khối lượng phân tử của khí carbon dioxide là: 12.x + 1.y = 16 (1)
%C = ⇒ x = 1
%H = ⇒ y = 4
Vậy công thức của hợp chất là CH4
Mở rộng: Biết công thức hóa học, tính phần trăm khối lượng các nguyên tố trong hợp chất.
Bột thuốc muối chữa đau dạ dày có công thức hóa học là NaHCO3 (natri hydrocarbonat hay sodium hydrocarbonate). Tính thành phần phần trăm các nguyên tố có trong hợp chất trên?
Hướng dẫn
Khối lượng phân tử NaHCO3 bằng 23.1 + 1.1 + 12 + 16.3 = 84 amu
Phần trăm khối lượng các nguyên tố hóa học trong NaHCO3 là:
%Na =
%H =
%C =
%O = 100% - 27,38% - 1,19% - 14,29% = 57,14%
Xem thêm lời giải bài tập Khoa học tự nhiên lớp 7 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Bài 6: Giới thiệu về liên kết hóa học
Bài 10: Đồ thị quãng đường - thời gian
Bài 11: Thảo luận về ảnh hưởng của tốc độ trong an toàn giao thông
Xem thêm các chương trình khác:
- Giải sgk Toán 7 – Kết nối tri thức
- Giải sbt Toán 7 – Kết nối tri thức
- Lý thuyết Toán 7 – Kết nối tri thức
- Giải VTH Toán 7 – Kết nối tri thức
- Chuyên đề dạy thêm Toán 7 cả 3 sách (2024 có đáp án)
- Giải sgk Lịch sử 7 – Kết nối tri thức
- Lý thuyết Lịch Sử 7 – Kết nối tri thức
- Giải sbt Lịch sử 7 – Kết nối tri thức
- Giải VTH Lịch sử 7 – Kết nối tri thức
- Soạn văn lớp 7 (hay nhất) – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn lớp 7 – Kết nối tri thức
- Soạn văn lớp 7 (ngắn nhất) – Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn lớp 7 – Kết nối tri thức
- Bố cục tác phẩm Ngữ văn lớp 7 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 7 – Kết nối tri thức
- Văn mẫu lớp 7 – Kết nối tri thức
- Giải VTH Ngữ văn lớp 7 – Kết nối tri thức
- Giải sgk Địa Lí 7 – Kết nối tri thức
- Lý thuyết Địa Lí 7 – Kết nối tri thức
- Giải sbt Địa lí 7 – Kết nối tri thức
- Giải VTH Địa lí 7 – Kết nối tri thức
- Giải sgk Tiếng Anh 7 Global Success – Kết nối tri thức
- Giải sbt Tiếng Anh 7 Global Success - Kết nối tri thức
- Bài tập Tiếng Anh 7 Global success theo Unit có đáp án
- Trọn bộ Từ vựng Tiếng Anh 7 Global success đầy đủ nhất
- Ngữ pháp Tiếng Anh 7 Global success
- Giải sgk Giáo dục công dân 7 – Kết nối tri thức
- Lý thuyết GDCD 7 – Kết nối tri thức
- Giải sbt Giáo dục công dân 7 – Kết nối tri thức
- Giải vth Giáo dục công dân 7 – Kết nối tri thức
- Giải sbt Hoạt động trải nghiệm lớp 7 - KNTT
- Giải sgk Hoạt động trải nghiệm 7 - KNTT
- Giải sgk Công nghệ 7 – Kết nối tri thức
- Lý thuyết Công nghệ 7 – Kết nối tri thức
- Giải sbt Công nghệ 7 – Kết nối tri thức
- Giải VTH Công nghệ 7 – KNTT
- Giải sgk Tin học 7 – Kết nối tri thức
- Lý thuyết Tin học 7 – Kết nối tri thức
- Giải sbt Tin học 7 – Kết nối tri thức
- Giải VTH Tin học 7 – Kết nối tri thức
- Giải sgk Giáo dục thể chất 7 – Kết nối tri thức
- Giải sgk Âm nhạc 7 – Kết nối tri thức