Giải Khoa học tự nhiên 7 Bài 6 (Kết nối tri thức): Giới thiệu về liên kết hóa học
Với lời giải bài tập Khoa học tự nhiên lớp 7 Bài 6: Giới thiệu về liên kết hóa học sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi và làm bài tập KHTN 7 Bài 6.
Giải bài tập Khoa học tự nhiên 7 Bài 6: Giới thiệu về liên kết hóa học
Video giải Khoa học tự nhiên 7 Bài 6: Giới thiệu về liên kết hóa học
A/ Câu hỏi đầu bài
Lời giải:
Nguyên tử của các nguyên tố khác khí hiếm có thể đạt được lớp electron ngoài cùng của khí hiếm bằng cách tạo thành liên kết hóa học.
- Liên kết ion được hình thành bởi lực hút giữa các ion mang điện tích trái dấu.
- Liên kết cộng hóa trị được tạo nên do sự dùng chung một hay nhiều cặp electron.
B/ Câu hỏi giữa bài
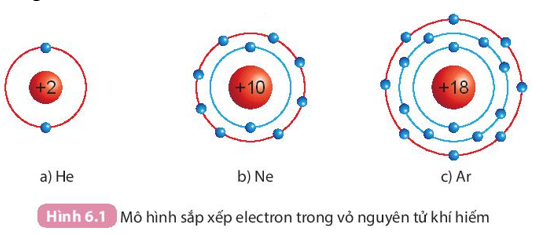
I. Cấu trúc electron bền vững của khí hiếm
Lời giải:
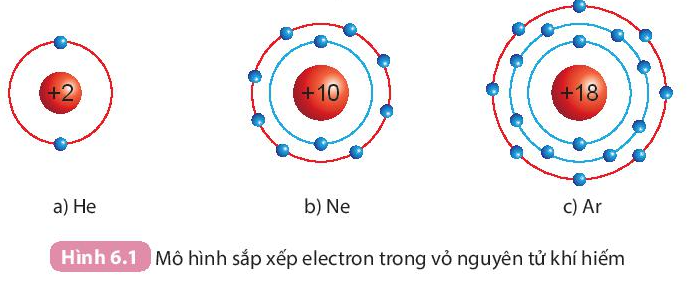
- He có 2 electron lớp ngoài cùng.
- Ne và Ar đều có 8 electron lớp ngoài cùng.
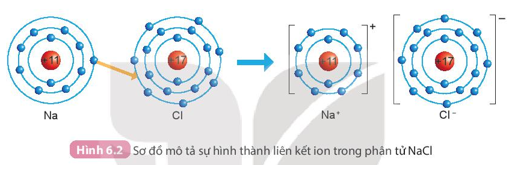
II. Liên kết ion
Lời giải:
Số electron ở lớp ngoài cùng của Na là 1, số electron ở lớp ngoài cùng của ion Na+ là 8.
Số electron ở lớp ngoài cùng của Cl là 7, số electron ở lớp ngoài cùng của ion Cl- là 8.
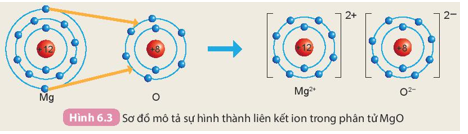
Hãy cho biết nguyên tử Mg đã nhường hay nhận bao nhiêu electron.
Lời giải:
Nguyên tử Mg có 2 electron ở lớp ngoài cùng. Khi hình thành liên kết, nguyên tử Mg đã nhường 2 electron này cho nguyên tử O
III. Liên kết cộng hóa trị
1. Liên kết cộng hóa trị trong phân tử đơn chất
Lời giải:
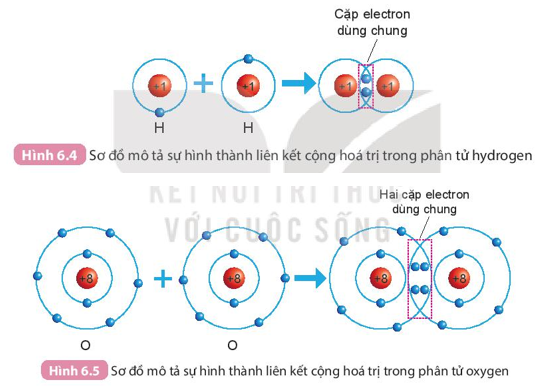
Quan sát hình 6.4 ta thấy:
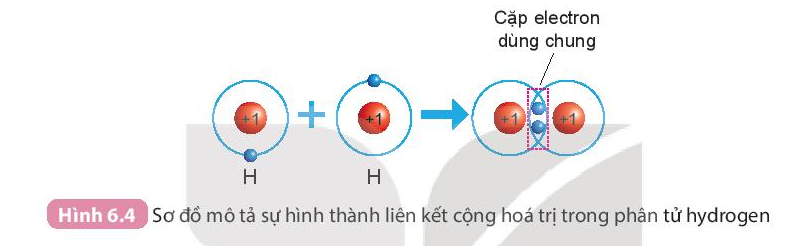
- Trước khi hình thành liên kết cộng hóa trị, mỗi nguyên tử H có 1 electron lớp ngoài cùng.
- Sau khi hình thành liên kết công hóa trị, mỗi nguyên tử H có 2 electron ở lớp ngoài cùng, 2 electron dùng chung cho cả hai nguyên tử H.
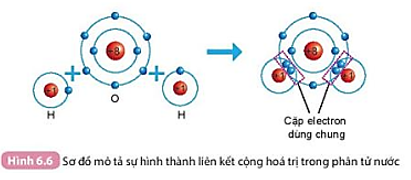
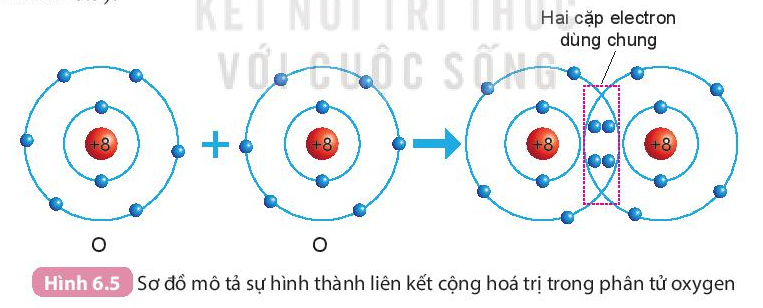
Quan sát hình 6.5 ta thấy:
- Trước khi hình thành liên kết cộng hóa trị, mỗi nguyên tử O có 6 electron lớp ngoài cùng.
- Sau khi hình thành liên kết công hóa trị, mỗi nguyên tử O có 8 electron ở lớp ngoài cùng, trong đó có 2 cặp electron dùng chung cho cả hai nguyên tử O.
Lời giải:
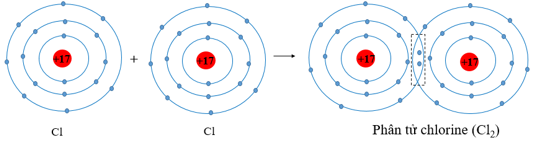
- Sự hình thành liên kết cộng hóa trị trong phân tử khí chlorine
+ Mỗi nguyên tử Cl có 7 electron ở lớp ngoài cùng.
+ Để có cấu trúc electron bền vững của khí hiếm Ar, khi hình thành phân tử khí chlorine, hai nguyên tử Cl đã liên kết với nhau bằng cách mỗi nguyên tử Cl góp chung 1 electron tạo thành một cặp electron dùng chung.
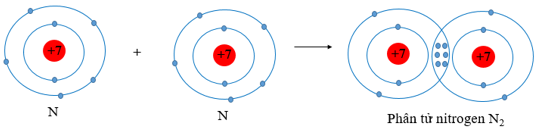
- Sự hình thành liên kết cộng hóa trị trong phân tử khí khí nitrogen
+ Mỗi nguyên tử N có 5 electron ở lớp ngoài cùng.
+ Để có cấu trúc electron bền vững của khí hiếm Ne, khi hình thành phân tử khí nitrogen, hai nguyên tử N đã liên kết với nhau bằng cách mỗi nguyên tử N góp chung 3 electron tạo thành ba cặp electron dùng chung.
2. Liên kết cộng hóa trị trong phân tử hợp chất
Lời giải:
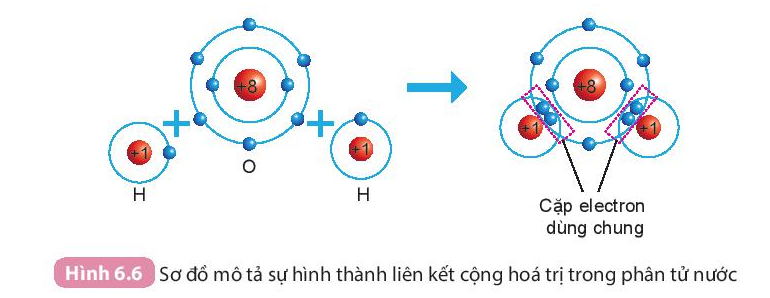
Khi nguyên tử O liên kết với hai nguyên tử H theo cách dùng chung electron thì lớp vỏ của nguyên tử oxygen có 8 electron giống với lớp vỏ của nguyên tử khí hiếm gần nhất là neon (Ne).
Lời giải:
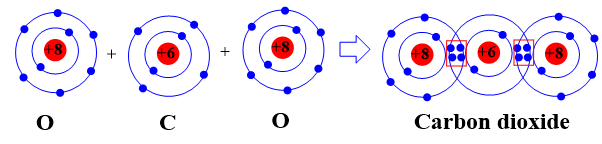
- Sự hình thành liên kết cộng hóa trị trong phân tử carbon dioxide
Khi hình thành phân tử carbon dioxide, hai nguyên tử O đã liên kết với một nguyên tử C bằng cách nguyên tử C đã góp chung với mỗi nguyên tử O hai electron tạo thành 2 cặp electron dùng chung.
- Sự hình thành liên kết cộng hóa trị trong phân tử ammonia
Khi hình thành phân tử ammonia, ba nguyên tử H đã liên kết với một nguyên tử N bằng cách nguyên tử N đã góp chung với mỗi nguyên tử H một electron tạo thành cặp electron dùng chung.
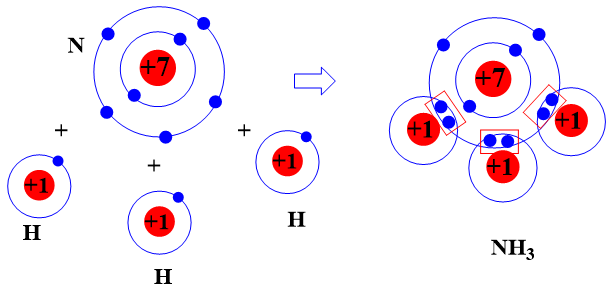
Lời giải:
- Muối ăn (NaCl) là hợp chất ion nên là chất rắn ở điều kiện thường, khó bay hơi, khó nóng chảy.
- Đường ăn và nước đá là hợp chất cộng hóa trị nên ở thể rắn, dễ nóng chảy và nước ở thể lỏng sẽ dễ bay hơi do các chất cộng hóa trị thường có nhiệt độ nóng chảy và nhiệt độ sôi thấp.
Bài giảng Khoa học tự nhiên lớp 7 Kết nối tri thức
Lý thuyết Khoa học tự nhiên 7 Bài 6: Giới thiệu về liên kết hóa học
I. Cấu trúc electron bền vững của khí hiếm
- Ở điều kiện thường, các khí hiếm tồn tại dưới dạng đơn nguyên tử bền vững, khó bị biến đổi hóa học. Lớp electron ngoài cùng của chúng chứa 8 electron (trừ He chứa 2 electron).
- Nguyên tử của các nguyên tố khác có xu hướng tham gia liên kết hóa học để đạt được lớp electron ngoài cùng giống khí hiếm bằng cách nhường, nhận hay dùng chung electron.
II. Liên kết ion
- Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
- Khi kim loại tác dụng với phi kim, nguyên tử kim loại nhường electron cho nguyên tử phi kim. Nguyên tử kim loại trở thành ion dương và nguyên tử phi kim trở thành ion âm. Các ion dương và âm hút nhau tạo thành liên kết trong hợp chất ion.
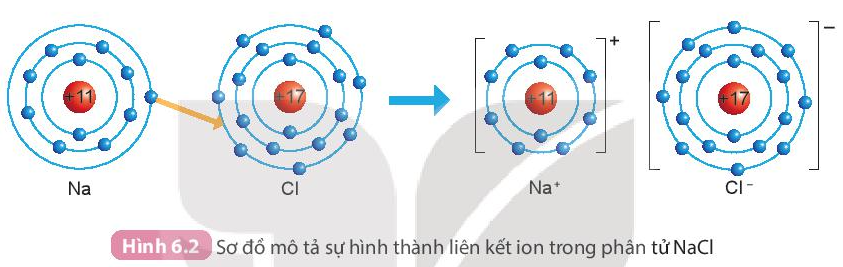
Ví dụ: Sự hình thành liên kết trong phân tử muối ăn (NaCl)
+ Nguyên tử sodium (Na) nhường một electron ở lớp electron ngoài cùng cho nguyên tử chlorine (Cl) đề tạo thành ion dương Na+ có vỏ bền vững giống vỏ nguyên tử khí hiếm He.
+ Nguyên tử Cl nhận vào lớp electron ngoài cùng một electron của nguyên tử Na để tạo thành ion âm Cl- có vỏ bền vững giống vỏ nguyên tử khí hiếm Ar.
+ Hai ion được tạo thành mang điện tích ngược dấu hút nhau để hình thành liên kết ion trong phân tử muối ăn.
- Liên kết ion thường được tạo thành giữa kim loại điển hình và phi kim điển hình.
+ Các hợp chất ion như muối ăn … là chất rắn ở điều kiện thường, khó bay hơi, khó nóng chảy và khi tan trong nước tạo thành dung dịch dẫn được điện.
III. Liên kết cộng hóa trị
Liên kết cộng hóa trị là liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung.
1. Liên kết công hóa trị trong phân tử đơn chất
- Liên kết cộng hóa trị thường gặp trong nhiều phân tử đơn chất phi kim như nitrogen, chlorine, fluorine,…
Ví dụ:
- Sự hình thành phân tử hydrogen
+ Mỗi nguyên tử H có một electron ở lớp ngoài cùng.
+ Để có cấu trúc electron bền vững của khí hiếm Ne, khi hình thành phân tử hydrogen, hai nguyên tử H đã liên kết với nhau bằng cách mỗi nguyên tử H góp chung 1 electron tạo thành 1 cặp electron dùng chung.
- Sự hình thành phân tử oxygen
- Mỗi nguyên tử O có 6 electron ở lớp ngoài cùng.
- Để có cấu trúc electron bền vững của khí hiếm Ne, khi hình thành phân tử oxygen, hai nguyên tử O đã liên kết với nhau bằng cách mỗi nguyên tử O góp chung 2 electron để tạo thành 2 cặp electron dùng chung.
2. Liên kết cộng hóa trị trong phân tử hợp chất
Ví dụ: Sự hình thành phân tử nước:
Khi hình thành phân tử nước, hai nguyên tử H đã liên kết với 1 nguyên tử O bằng cách nguyên tử O góp chung với mỗi nguyên tử H một electron tạo thành cặp electron dùng chung.
- Các chất hydrogen, oxygen và nước, carbon dioxide, ammonia,… chỉ chứa các liên kết cộng hóa trị, được gọi là chất cộng hóa trị.
- Các chất cộng hóa trị có thể là chất rắn, chất lỏng hoặc chất khí;
+ Các chất cộng hóa trị thường có nhiệt độ nóng chảy và nhiệt độ sôi thấp.
Bảng so sánh một số tính chất của chất ion với chất cộng hóa trị
|
Tính chất |
Chất ion |
Chất cộng hóa trị |
|
Trạng thái (ở điều kiện thường) |
Thể rắn |
Cả ba thể (rắn, lỏng, khí) |
|
Nhiệt độ sôi, nhiệt độ nóng chảy |
Cao |
Thấp |
|
Dẫn điện |
Tan trong nước tạo dung dịch dẫn được điện |
Nhiều chất không dẫn điện (đường ăn, ethanol,…) |
Xem thêm lời giải bài tập Khoa học tự nhiên lớp 7 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Bài 7: Hóa trị và công thức hóa học
Bài 10: Đồ thị quãng đường - thời gian
Bài 11: Thảo luận về ảnh hưởng của tốc độ trong an toàn giao thông
Xem thêm các chương trình khác:
- Giải sgk Toán 7 – Kết nối tri thức
- Giải sbt Toán 7 – Kết nối tri thức
- Lý thuyết Toán 7 – Kết nối tri thức
- Giải VTH Toán 7 – Kết nối tri thức
- Chuyên đề dạy thêm Toán 7 cả 3 sách (2024 có đáp án)
- Giải sgk Lịch sử 7 – Kết nối tri thức
- Lý thuyết Lịch Sử 7 – Kết nối tri thức
- Giải sbt Lịch sử 7 – Kết nối tri thức
- Giải VTH Lịch sử 7 – Kết nối tri thức
- Soạn văn lớp 7 (hay nhất) – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn lớp 7 – Kết nối tri thức
- Soạn văn lớp 7 (ngắn nhất) – Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn lớp 7 – Kết nối tri thức
- Bố cục tác phẩm Ngữ văn lớp 7 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 7 – Kết nối tri thức
- Văn mẫu lớp 7 – Kết nối tri thức
- Giải VTH Ngữ văn lớp 7 – Kết nối tri thức
- Giải sgk Địa Lí 7 – Kết nối tri thức
- Lý thuyết Địa Lí 7 – Kết nối tri thức
- Giải sbt Địa lí 7 – Kết nối tri thức
- Giải VTH Địa lí 7 – Kết nối tri thức
- Giải sgk Tiếng Anh 7 Global Success – Kết nối tri thức
- Giải sbt Tiếng Anh 7 Global Success - Kết nối tri thức
- Bài tập Tiếng Anh 7 Global success theo Unit có đáp án
- Trọn bộ Từ vựng Tiếng Anh 7 Global success đầy đủ nhất
- Ngữ pháp Tiếng Anh 7 Global success
- Giải sgk Giáo dục công dân 7 – Kết nối tri thức
- Lý thuyết GDCD 7 – Kết nối tri thức
- Giải sbt Giáo dục công dân 7 – Kết nối tri thức
- Giải vth Giáo dục công dân 7 – Kết nối tri thức
- Giải sbt Hoạt động trải nghiệm lớp 7 - KNTT
- Giải sgk Hoạt động trải nghiệm 7 - KNTT
- Giải sgk Công nghệ 7 – Kết nối tri thức
- Lý thuyết Công nghệ 7 – Kết nối tri thức
- Giải sbt Công nghệ 7 – Kết nối tri thức
- Giải VTH Công nghệ 7 – KNTT
- Giải sgk Tin học 7 – Kết nối tri thức
- Lý thuyết Tin học 7 – Kết nối tri thức
- Giải sbt Tin học 7 – Kết nối tri thức
- Giải VTH Tin học 7 – Kết nối tri thức
- Giải sgk Giáo dục thể chất 7 – Kết nối tri thức
- Giải sgk Âm nhạc 7 – Kết nối tri thức