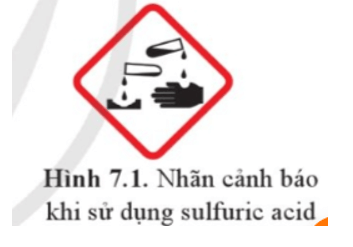
Giải Hóa 11 Bài 7 (Cánh diều): Sulfuric acid và muối sulfate
Với giải bài tập Hóa 11 Bài 7: Sulfuric acid và muối sulfate sách Cánh diều hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 11 Bài 7.
Giải Hóa 11 Bài 7: Sulfuric acid và muối sulfate
Lời giải:
- Hình ảnh dán trên chai đựng sulfuric acid cho biết đây là hoá chất ăn mòn.
- Nguyên nhân gây ra hiện tượng trong hình là do sulfuric acid có tính acid mạnh, đặc biệt sulfuric acid đặc có tính oxi hoá mạnh và tính háo nước.
I. Sulfuric acid
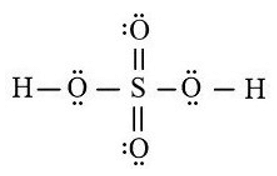
Câu hỏi 1 trang 44 Hoá học 11: Hãy viết công thức Lewis của phân tử H2SO4.
Lời giải:
Công thức Lewis của H2SO4:
Lời giải:
Hiện tượng:
- Ống nghiệm 1: Không thấy xuất hiện hiện tượng gì.
- Ồng nghiệm 2: Mảnh đồng tan dần, có khí không màu thoát ra, sau phản ứng thu được dung dịch có màu xanh.
Phương trình hoá học:
Trong phản ứng, số oxi hoá của sulfur giảm từ +6 xuống +4 nên H2SO4 đóng vai trò là chất oxi hoá; số oxi hoá của Cu tăng từ 0 lên +2 nên Cu đóng vai trò là chất khử.
Thí nghiệm 2 trang 45 Hoá học 11: Tính háo nước và tính oxi hoá của dung dịch sulfuric acid đặc
Yêu cầu: Quan sát hiện tượng. Giải thích và viết phương trình hoá học.
Chú ý an toàn: Cẩn thận khi sử dụng dung dịch sulfuric acid.
Lời giải:
- Hiện tượng: Đường kính hoặc bột gạo hay bột mì dần dần hoá than, có hiện tượng sủi bọt đẩy C trào ra ngoài cốc.
- Giải thích: Các hợp chất đường kính, bột gạo hay bột mì … (công thức tổng quát có dạng Cn(H2O)m) bị than hoá do phản ứng tạo ra carbon. Một phần carbon sinh ra tiếp tục bị oxi hoá bởi acid tạo thành khí, đẩy carbon trào ra ngoài cốc.
- Phương trình hoá học:
Cn(H2O)m(s) nC(s) + mH2O(l)
C(s) + 2H2SO4 (aq) → CO2(g) + 2SO2(g) + 2H2O(l).
Lời giải:
Các phương trình hoá học xảy ra:
Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g);
ZnO(s) + H2SO4(aq) → ZnSO4(aq) + H2O(l);
Ba(OH)2(aq) + H2SO4(aq) → BaSO4(s) + 2H2O(l);
Na2CO3(aq) + H2SO4(aq) → Na2SO4(aq) + CO2(g) + H2O(l).
Lời giải:
Trong hợp chất H2SO4, sulfur có số oxi hoá là +6, đây là số oxi hoá cao nhất của sulfur do đó H2SO4 không thể hiện tính khử.
Lời giải:
Hiện tượng: Hạt cơm dần dần hoá than, có hiện tượng sủi bọt.
Phương trình hoá học:
(C6H10O5)n(s) 6nC(s) + 5nH2O(l)
C(s) + 2H2SO4 (aq) → CO2(g) + 2SO2(g) + 2H2O(l).
Lời giải:
Cách loại bỏ lọ acid này: Sử dụng dung dịch base (ví dụ: nước vôi trong) để trung hoà acid, đưa về các muối trung hoà.
Ca(OH)2(aq) + H2SO4(aq) → CaSO4(s) + 2H2O(l).
Lời giải:
Phát biểu trên là sai. Do chất xúc tác làm tăng tốc độ phản ứng thuận và tốc độ phản ứng nghịch với số lần bằng nhau, do đó chất xúc tác không làm cân bằng chuyển dịch.
Lời giải:
- Một số nguyên nhân dẫn đến rủi ro, sự cố:
+ Nổ bình chứa, ống dẫn khí SO2, SO3.
+ Vỡ, thủng các bồn chứa acid.
+ Rò rỉ hệ thống đường ống dẫn hơi, các van, mối nối trên hệ thống đường ống.
+ Cháy nổ do chập điện…
- Một số biện pháp đề xuất để hạn chế tác hại:
+ Thực hiện nghiêm túc nội quy an toàn lao động; trang bị đầy đủ các phương tiện bảo vệ cá nhân (quần áo bảo hộ lao động, kính mắt, gang tay, ủng …) khi làm việc.
+ Thường xuyên kiểm tra máy móc, thiết bị vận hành…
+ Sử dụng các thiết bị tách mù tiên tiến, có hiệu xuất xử lí cao, ví dụ như thiết bị tách mù acid bằng lọc bụi tĩnh điện ướt (ở nhà máy Super phosphate Lâm Thao) …
II. Muối sulfate
Lời giải:
Cách 1: Sử dụng phương pháp vật lí:
Ở 20oC, độ tan của CaSO4 là 0,2 g/ 100 g nước; độ tan của NaHCO3 là 7,8 g/ 100 g nước.
Do đó có thể hoà tan lần lượt 5 gam mỗi chất vào từng cốc chứa 100 gam nước. Nếu:
+ Cốc nào chất rắn tan hết là NaHCO3.
+ Cốc nào chất rắn không tan hết là thạch cao nung (CaSO4. 0,5H2O).
Cách 2: Sử dụng phương pháp hoá học:
Trích mẫu thử, sau đó cho lần lượt từng mẫu thử tác dụng với H2SO4.
+ Nếu mẫu thử tan dần, có khí thoát ra là NaHCO3:
2NaHCO3(s) + H2SO4(aq) → Na2SO4(aq) + CO2(g) + 2H2O(l).
+ Nếu không có khí thoát ra là thạch cao nung (CaSO4. 0,5H2O).
Lời giải:
Đánh số thứ tự từng mẫu phân đạm, trích mỗi loại một ít sang ống nghiệm đánh số tương ứng (trích mẫu thử);
Cho lần lượt từng mẫu thử tác dụng với dung dịch barium hydroxide (Ba(OH)2), đun nóng. Nếu:
+ Không có hiện tượng gì xuất hiện → mẫu thử là NaNO3;
+ Thoát ra khí mùi khai, xốc → mẫu thử là NH4Cl;
2NH4Cl(s) + Ba(OH)2(aq) → BaCl2(aq) + 2NH3(g) + 2H2O(l);
+ Vừa thoát ra khí mùi khai, xốc; vừa có kết tủa xuất hiện → mẫu thử là (NH4)2SO4;
(NH4)2SO4(s) + Ba(OH)2(aq) → BaSO4(s) + 2NH3(g) + 2H2O (l).
Bài tập (trang 50)
b) Tính thể tích dung dịch H2SO4 0,05 M cần dùng để trung hoà 10 mL dung dịch NaOH có pH = 13.
Lời giải:
a) Số mol H2SO4 có trong dung dịch cần pha chế là:
n = 0,5.0,05 = 0,025 mol;
Khối lượng dung dịch H2SO4 98% cần dùng để pha chế là:
Thể tích dung dịch H2SO4 98% cần dùng để pha chế là:
b) Dung dịch NaOH có pH = 13
Phản ứng trung hoà:
H+ + OH− → H2O
Hãy giải thích nguyên nhân có mặt của sulfuric acid trong hồ.
Lời giải:
Khi núi lửa hoạt động, các hợp chất chứa sulfur sẽ bị oxi hoá tạo ra khí SO2. Sau đó SO2 tiếp tục bị oxi hoá tạo ra SO3.
SO3 sinh ra tan vào nước hồ, đó chính là nguyên nhân sự có mặt của sulfuric acid trong hồ.
Lời giải:
Ở 20 oC, độ tan của muối magnesium sulfate là 35,1 gam/ 100 gam nước; còn độ tan của muối barium sulfate là 0,245 miligam/ 100 gam nước.
Do đó, có thể dựa vào tính chất vật lí (khả năng tan trong nước) để phân biệt nhanh muối magnesium sulfate và muối barium sulfate.
Bài 4 trang 50 Hoá học 11: Viết phương trình hoá học của các phản ứng theo dãy chuyển hoá dưới đây.
FeS2 → SO2 → SO3 → H2SO4 → (NH4)2SO4.
Lời giải:
(1) 4FeS2 + 11O2 2Fe2O3 + 8SO2;
(2) ;
(3) SO3 + H2O → H2SO4;
(4) H2SO4 + 2NH3 → (NH4)2SO4.
Lý thuyết Sulfuric acid và muối sulfate
I. Sulfuric acid
1. Cấu tạo phân tử và tính chất vật lí
- Cấu tạo phân tử:
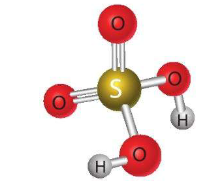
- Tính chất vật lí:
+ Là chất lỏng sánh như dầu, không màu, không bay hơi.
+ Dung dịch sulfuric acid đặc có khả năng hút ẩm.
2. Tính chất hóa học
a, Tính chất hóa học của dung dịch sulfuric acid loãng
+ Đổi màu quý tím thành đỏ
+ Tác dụng với kim loại hoạt động.
+ Tác dụng với basic oxide và base.
+ Tác dụng với nhiều muối.
b, Tính chất hóa học của dung dịch sulfuric acid đặc
- Tính oxi hóa mạnh
+ Oxi hóa hầu hết các kim loại (trừ vàng, platinium), nhiều phi kim như carbon, sulfur, phosphorus… và nhiều hợp chất
VD: H2SO4 + Cu → CuSO4 + SO2 + 2H2O
2H2SO4 + S → 3SO2 + 2H2O
- Tính háo nước
+ Dung dịch sulfuric acid đặc hấp thụ mạnh nước.
3. Bảo quản và xử lí bỏng sulfuric acid
- Bảo quản: Chai, lọ đựng sulfuric acid phải để ở nơi ít có nguy cơ bị va chạm, xa nguồn nhiệt và các hóa chất khác.
- Xử lí bỏng sulfuric acid: Sơ cứu người bị bỏng bằng cách rửa vết bỏng dưới vòi nước sạch ít nhất 20 phút trước khi đưa đến cơ sở y tế.
+ Tuyệt đối không chườm đá lạnh, khong xoa vết bỏng bằng các loại kem, gel, dầu …
4. Ứng dụng và sản xuất sulfuric acid
a, Ứng dụng
- Sản xuất phân bón.
- Chất tẩy rửa, phẩm màu, thuốc trừ sâu…
b, Sản xuất sulfuric acid bằng phương pháp tiếp xúc
S(s) + O2(g) → SO2(g)
4FeS2(s) + 11O2(g) → 2Fe2O3(s) + 8SO2(g)
2SO2 + O2(g) → 2SO3
H2SO4(aq) + nSO3(g) → H2SO4.nSO3(l)
H2SO4.nSO3 (l) + nH2O → (n+1) H2SO4
II. Muối sulfate
1. Một số muối sulfate
- Muối sulfate đa số đều tan trong nước, CaSO4 rất ít tan, BaSO4 không tan trong nước.
- Ứng dụng của một số muối:
+ (NH4)2SO4: dùng làm phân bón cung cấp đạm.
+ MgSO4: Chủ yếu dùng làm phân bón.
+ CaSO4.2H2O (thạch cao tự nhiên); CaSO4.0,5H2O (thạch cao nung): hút nước, sử dụng trong vật liệu xây dựng, đúc tượng …
+ BaSO4: Sơn, mực in, nhựa, lớp phủ, men, …
2. Nhận biết ion SO42- trong dung dịch
Ba2+ + SO42- → BaSO4
Xuất hiện kết tủa trắng (BaSO4)
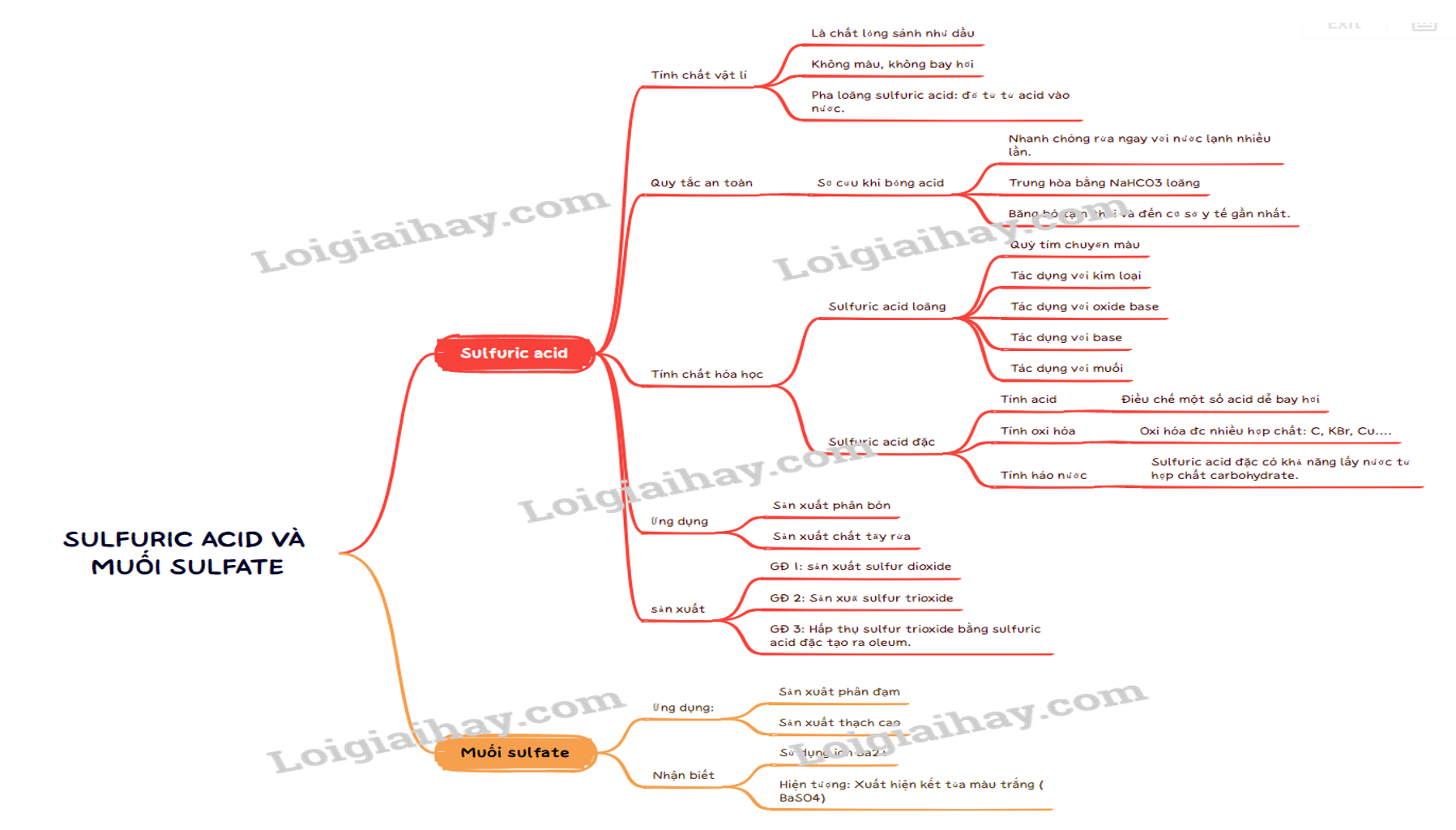
Sơ đồ tư duy Sulfuric acid và muối sulfate
Xem thêm lời giải bài tập Hóa học lớp 11 Cánh diều hay, chi tiết khác:
Bài 5: Một số hợp chất quan trọng của nitrogen
Bài 6: Sulfur và sulfur dioxide
Xem thêm các chương trình khác:
- Soạn văn lớp 11 Cánh diều (hay nhất)
- Văn mẫu lớp 11 - Cánh diều
- Tóm tắt tác phẩm Ngữ văn 11 – Cánh diều
- Tác giả tác phẩm Ngữ văn 11 - Cánh diều
- Giải SBT Ngữ văn 11 – Cánh diều
- Bố cục tác phẩm Ngữ văn 11 – Cánh diều
- Giải Chuyên đề học tập Ngữ văn 11 – Cánh diều
- Nội dung chính tác phẩm Ngữ văn lớp 11 – Cánh diều
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 – Cánh diều
- Giải Chuyên đề học tập Toán 11 – Cánh diều
- Lý thuyết Toán 11 - Cánh diều
- Giải sbt Toán 11 – Cánh diều
- Giải sgk Tiếng Anh 11 – ilearn Smart World
- Giải sbt Tiếng Anh 11 - ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh 11 ilearn Smart World đầy đủ nhất
- Giải sgk Vật lí 11 – Cánh diều
- Lý thuyết Vật lí 11 – Cánh diều
- Giải sbt Vật lí 11 – Cánh diều
- Giải Chuyên đề học tập Vật lí 11 – Cánh diều
- Giải sgk Sinh học 11 – Cánh diều
- Lý thuyết Sinh học 11 – Cánh diều
- Giải Chuyên đề học tập Sinh học 11 – Cánh diều
- Giải sbt Sinh học 11 – Cánh diều
- Giải sgk Giáo dục Kinh tế và Pháp luật 11 – Cánh diều
- Giải Chuyên đề học tập Kinh tế pháp luật 11 – Cánh diều
- Lý thuyết Kinh tế pháp luật 11 – Cánh diều
- Giải sbt Kinh tế pháp luật 11 – Cánh diều
- Giải sgk Lịch sử 11 – Cánh diều
- Giải Chuyên đề học tập Lịch sử 11 – Cánh diều
- Lý thuyết Lịch sử 11 - Cánh diều
- Giải sbt Lịch sử 11 – Cánh diều
- Giải sgk Địa lí 11 – Cánh diều
- Giải Chuyên đề học tập Địa lí 11 – Cánh diều
- Lý thuyết Địa lí 11 - Cánh diều
- Giải sbt Địa lí 11 – Cánh diều
- Giải sgk Công nghệ 11 – Cánh diều
- Lý thuyết Công nghệ 11 - Cánh diều
- Giải sbt Công nghệ 11 – Cánh diều
- Giải sgk Tin học 11 – Cánh diều
- Giải Chuyên đề học tập Tin học 11 – Cánh diều
- Lý thuyết Tin học 11 - Cánh diều
- Giải sbt Tin học 11 – Cánh diều
- Giải sgk Giáo dục quốc phòng an ninh 11 – Cánh diều
- Lý thuyết Giáo dục quốc phòng 11 – Cánh diều
- Giải sbt Giáo dục quốc phòng 11 – Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 – Cánh diều