Giải Hóa 11 Bài 1 (Cánh diều): Mở đầu về cân bằng hoá học
Với giải bài tập Hóa 11 Bài 1: Mở đầu về cân bằng hoá học sách Cánh diều hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 11 Bài 1.
Giải Hóa 11 Bài 1: Mở đầu về cân bằng hoá học
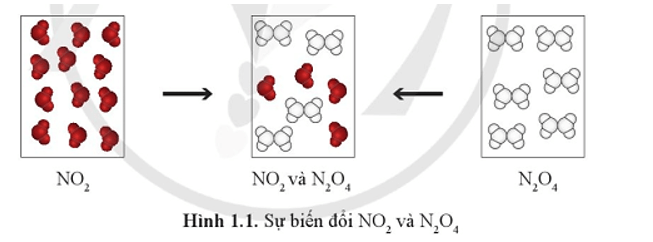
Tại thời điểm hỗn hợp khí trong hai bình có thành phần như nhau, có phản ứng diễn ra trong hai bình này không?
Lời giải:
Tại thời điểm hỗn hợp khí trong hai bình có thành phần như nhau, phản ứng vẫn tiếp diễn trong hai bình.
Tuy nhiên, nồng độ của một chất bất kì trong phản ứng không đổi là do lượng mất đi và lượng sinh ra chất đó là bằng nhau.
I. Khái niệm phản ứng thuận nghịch và trạng thái cân bằng
Câu hỏi 1 trang 7 Hoá học 11: Hãy nêu một số ví dụ về phản ứng thuận nghịch mà em biết.
Lời giải:
Một số ví dụ về phản ứng thuận nghịch:
+ Phản ứng của khí chlorine với nước:
Cl2(aq) + H2O(l) ⇌ HCl(aq) + HClO(aq).
+ Phản ứng hình thành hang động, thạch nhũ trong tự nhiên:
CaCO3(s) + CO2(aq) + H2O(l) ⇌ Ca(HCO3)2(aq)
+ Phản ứng của hơi iodine với khí hydrogen:
H2(g) + I2(g) ⇌ 2HI(g)
Luyện tập 1 trang 7 Hoá học 11: Phản ứng thuận nghịch có xảy ra hoàn toàn được không? Vì sao?
Lời giải:
Phản ứng thuận nghịch xảy ra không hoàn toàn. Do phản ứng thuận nghịch xảy ra đồng thời sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng (ở cùng điều kiện).
Câu hỏi 2 trang 7 Hoá học 11: Xét ví dụ 2:
Lời giải:
Quá trình trộn khí hydrogen với hơi iodine được thể hiện qua phản ứng thuận nghịch:
H2(g) + I2(g) ⇌ 2HI(g)
a) Tại thời điểm ban đầu, ngay khi vừa mới trộn khí H2 và hơi I2 với nhau, chưa có HI tạo thành, nồng độ H2 và I2 là lớn nhất. Nồng độ của I2 lớn nhất nên màu tím của hỗn hợp là đậm nhất.
Sau khi trộn khí H2 và hơi I2, phản ứng thuận diễn ra và nồng độ H2 và I2 giảm dần nên màu tím của hỗn hợp khí cũng nhạt dần.
b) Sau một khoảng thời gian, màu tím của hỗn hợp không thay đổi, chứng tỏ nồng độ của một chất bất kì trong phản ứng không đổi (do lượng mất đi và lượng sinh ra chất đó là bằng nhau).
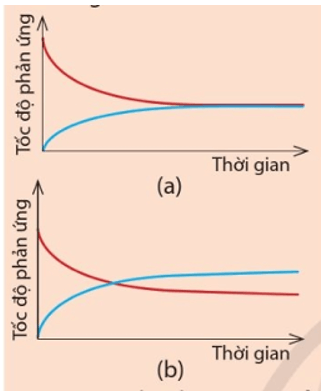
Hãy cho biết đồ thị nào thể hiện đúng Ví dụ 2. Đường màu xanh trong đồ thị đó biểu diễn tốc độ phản ứng thuận hay tốc độ phản ứng nghịch?
Lời giải:
Đồ thị (a) thể hiện đúng Ví dụ 2. Do sau một khoảng thời gian nhất định, tốc độ của phản ứng thuận bằng tốc độ của phản ứng nghịch.
Đường màu xanh trong đồ thị biểu diễn tốc độ phản ứng nghịch. Do sau khi trộn hai khí, phản ứng thuận diễn ra, nồng độ H2 và I2 giảm dần nên vthuận giảm dần. Trong khi đó, lượng HI sinh ra theo phản ứng thuận càng nhiều và nồng độ HI tăng nên v nghịch tăng dần.
Câu hỏi 4 trang 8 Hoá học 11: Vì sao giá trị là một hằng số ở nhiệt độ xác định?
Lời giải:
kt, kn lần lượt là hằng số tốc độ phản ứng thuận, hằng số tốc độ phản ứng nghịch mà giá trị của kt, kn chỉ phụ thuộc vào nhiệt độ và bản chất của các chất tham gia phản ứng, nên tại một nhiệt độ xác định giá trị là hằng số.
II. Biểu thức hằng số cân bằng và ý nghĩa
Câu hỏi 5 trang 9 Hoá học 11: Viết biểu thức hằng số cân bằng KC cho phản ứng thuận nghịch:
Lời giải:
a) N2(g) + 3H2(g) ⇌ 2NH3(g)
Biểu thức hằng số cân bằng:
b) CaCO3(s) ⇌ CaO(s) + CO2(g)
Biểu thức hằng số cân bằng: KC = [CO2]
Câu hỏi 6 trang 9 Hoá học 11: Viết biểu thức hằng số cân bằng KC cho phản ứng (*), (**) dưới đây.
Theo em, giá trị hai hằng số cân bằng này có bằng nhau không?
Lời giải:
H2(g) + I2(g) ⇌ 2HI(g) (*)
Biểu thức hằng số cân bằng cho phản ứng (*):
Biểu thức hằng số cân bằng cho phản ứng (**):
Theo em, giá trị hai hằng số cân bằng này bằng nhau. Do giá trị KC chỉ phụ thuộc vào bản chất của các chất trong cân bằng và nhiệt độ.
Luyện tập 2 trang 9 Hoá học 11: Trong công nghiệp, halogen được sản xuất từ phản ứng:
CH4(g) + H2O(g) ⇌ 3H2(g) + CO(g)
a) Tính hằng số cân bằng KC của phản ứng trên ở 760 oC.
Lời giải:
a) Hằng số cân bằng KC của phản ứng ở 760 oC là:
b) Ta có: CH4(g) + H2O(g) ⇌ 3H2(g) + CO(g)
Ban đầu: x x 0 0 M
Phản ứng: 0,2 0,2 0,6 0,2 M
Cân bằng: (x – 0,2) (x – 0,2) 0,6 0,2 M
Do giá trị KC chỉ phụ thuộc vào bản chất của các chất trong cân bằng và nhiệt độ. Nên:
⇒ 0,0432 = 6,285x2 – 2,514x + 0,2514
⇒ 6,285x2 – 2,514x + 0,2082 = 0
⇒ x = 0,283 (thoả mãn); x = 0,12 (loại do 0,12 < 0,2).
Lời giải:
Biểu thức hằng số cân bằng của phản ứng: N2(g) + 3H2(g) ⇌ 2NH3(g) là:
Vậy để thu được nhiều NH3 hơn cần tăng nồng độ của N2 và H2.
Lời giải:
- Tính nồng độ H+ của dung dịch acid HA:
Ta có: HA ⇌ H+ + A-
Ban đầu: 0,5 0 0 M
Phản ứng: x x x M
Cân bằng: (0,5 – x) x x M
KC(HA) = 0,2 ⇒
⇒ x2 + 0,2x - 0,1 = 0
⇒ x = 0,231 (thoả mãn).
- Tính nồng độ H+ của dung dịch acid HB:
Ta có: HB ⇌ H+ + B-
Ban đầu: 0,5 0 0 M
Phản ứng: y y y M
Cân bằng: (0,5 – y) y y M
KC(HB) = 0,1 ⇒
⇒ y2 + 0,1y – 0,05 = 0
⇒ y = 0,179 (thoả mãn).
Nhận xét:
Hằng số phân li acid càng lớn, acid càng mạnh.
CO(g) + 2H2(g) ⇌ CH3OH(g) KC = 2,26.104 (1)
CO2(g) + 3H2(g) ⇌ CH3OH(g) + H2O(g) KC = 8,27.10-1 (2)
Lời giải:
Phản ứng (1) thích hợp để điều chế CH3OH.
Do phản ứng (1) là phản ứng thuận nghịch có KC = 2,26.104 rất lớn so với 1 nên phản ứng thuận diễn ra thuận lợi hơn rất nhiều so với phản ứng nghịch; các chất ở trạng thái cân bằng chủ yếu là chất sản phẩm.
III. Ảnh hưởng của nhiệt độ, nồng độ và áp suất đến cân bằng hoá học
Yêu cầu: Quan sát hiện tượng và giải thích.
Chú ý an toàn: Khí NO2 độc nên tránh hít phải khí NO2. Nên làm thí nghiệm này trong tủ hốt.
Lời giải:
Hiện tượng:
+ Ống nghiệm thứ hai (2) nhúng vào cốc nước nóng, hỗn hợp trong ống nghiệm có màu đậm dần lên.
+ Ống nghiệm thứ ba (3) nhúng vào cốc nước đá, hỗn hợp trong ống nghiệm trở nên nhạt màu hơn.
Giải thích:
2NO2(g) ⇌ N2O4(g)
⇒ Chiều thuận toả nhiệt.
+ Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều nghịch (tức chiều phản ứng thu nhiệt) nên hỗn hợp có màu nâu đậm hơn.
+ Khi giảm nhiệt độ, cân bằng chuyển dịch theo chiều thuận (tức chiều phản ứng toả nhiệt) nên hỗn hợp trở nên nhạt màu hơn.
Câu hỏi 8 trang 11 Hoá học 11: Từ Thí nghiệm 1, hãy cho biết:
b*) Khi tăng nhiệt độ hoặc giảm nhiệt độ, cân bằng chuyển dịch theo chiều thu nhiệt hay toả nhiệt?
Lời giải:
a) Dựa vào màu sắc của khí trong ống nghiệm để biết trạng thái cân bằng của phản ứng bị dịch chuyển khi thay đổi nhiệt độ.
b) Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều làm giảm nhiệt độ, tức là chiều phản ứng thu nhiệt, nghĩa là chiều làm giảm tác động của việc tăng nhiệt độ.
Khi giảm nhiệt độ, cân bằng chuyển dịch theo chiều làm tăng nhiệt độ, tức là chiều phản ứng toả nhiệt, nghĩa là chiểu làm giảm tác động của việc giảm nhiệt độ.
Thí nghiệm 2 trang 12 Hoá học 11: Chuẩn bị: CH3COONa tinh thể; ống nghiệm, cốc thuỷ tinh.
Cho biết giữa ion acetate và nước có phản ứng thuận nghịch sau:
Yêu cầu: Thảo luận về chiều chuyển dịch cân bằng trên khi nhiệt độ tăng lên.
Lời giải:
Hiện tượng:
Sau khoảng 2 phút, thấy ống nghiệm B có màu đậm hơn so với ống nghiệm A.
Kết quả thảo luận:
Khi nhiệt độ tăng lên, cân bằng chuyển dịch theo chiều thuận.
Lời giải:
Khi tăng nhiệt độ thì cân bằng (9) chuyển dịch theo chiều thuận tức chiều làm tăng nồng độ OH-, làm màu dung dịch đậm lên.
Luyện tập 5 trang 12 Hoá học 11: Cân bằng sau chuyển dịch theo chiều nào khi tăng nhiệt độ?
Lời giải:
⇒Chiều thuận toả nhiệt.
Khi tăng nhiệt độ, cân bằng sẽ chuyển dịch theo chiều chống lại sự thay đổi đó, nghĩa là theo chiều giảm nhiệt độ, đó là chiều nghịch (chiều phản ứng thu nhiệt).
Lời giải:
Khi tăng áp suất của hỗn hợp, cân bằng sẽ chuyển dịch theo chiều chống lại sự thay đổi đó, nghĩa là theo chiều giảm áp suất (hay chính là chiều giảm số mol khí), tức chiều thuận.
Lời giải:
Phản ứng tổng hợp NH3 từ N2 và H2:
N2(g) + 3H2(g) ⇌ 2NH3(g)
Dự đoán: Phản ứng nên thực hiện ở áp suất cao, do ở áp suất cao, cân bằng sẽ chuyển dịch theo chiều chống lại sự thay đổi đó, nghĩa là theo chiều giảm áp suất (hay chính là chiều giảm số mol khí), tức chiều thuận (tăng hiệu suất tổng hợp NH3).
Thực tế, phản ứng tổng hợp NH3 ở các nhà máy thường được thực hiện ở áp suất 200 – 300 atm.
CH3COOH(aq) + ROH(aq) ⇌ CH3CHOOR(aq) + H2O(l)
Lời giải:
Để nâng cao hiệu suất của phản ứng (tức thu được hỗn hợp chất chứa nhiều ester này) có thể lấy dư một trong hai chất đầu (tăng nồng độ một trong hai chất đầu) hoặc làm giảm nồng độ các sản phẩm.
Bài tập (trang 14)
A. Tốc độ của phản ứng thuận bằng tốc độ của phản ứng nghịch.
B. Nồng độ của tất cả các chất trong hỗn hợp phản ứng là không đổi.
C. Nồng độ mol của chất phản ứng luôn bằng nồng độ mol của chất sản phẩm phản ứng.
D. Phản ứng thuận và phản ứng nghịch vẫn diễn ra.
Lời giải:
Đáp án đúng là: C
Khi phản ứng thuận nghịch ở trạng thái cân bằng thì:
+ Tốc độ của phản ứng thuận bằng tốc độ của phản ứng nghịch.
+ Nồng độ của tất cả các chất trong hỗn hợp phản ứng là không đổi.
+ Phản ứng thuận và phản ứng nghịch vẫn diễn ra.
Lời giải:
Do dung tích bình là 1 lít nên giá trị nồng độ bằng giá trị của số mol.
Ta có: 2SO2(g) + O2(g) ⇌ 2SO3(g)
Ban đầu: 0,4 0,6 0 M
Phản ứng: 0,3 0,15 0,3 M
Cân bằng: 0,1 0,45 0,3 M
Hằng số cân bằng KC của phản ứng tổng hợp SO3 là:
Ca(HCO3)2 (aq) ⇌ CaCO3(s) + CO2(aq) + H2O(l)
Lời giải:
Nếu nồng độ CO2 hoà tan trong nước tăng lên thì không thuận lợi cho sự hình thành nhũ đá. Do nồng độ CO2 tăng, cân bằng sẽ chuyển dịch theo chiều làm giảm nồng độ CO2, tức chiều nghịch.
Lý thuyết Mở đầu về cân bằng hoá học
I. Khái niệm phản ứng thuận nghịch và trạng thái cân bằng
- Phản ứng thuận nghịch là phản ứng trong đó ở cùng điều kiện, xảy ra đồng thời sựu chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng.
- Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái mà tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
II. Biểu thức hằng số cân bằng và ý nghĩa
1. Biểu thức hằng số cân bằng
- Xét phản ứng thuận nghịch tổng quát: aA + bB cC + dD.
Ở trạng thái cân bằng, hằng số cân bằng (KC) được xác định theo biểu thức:
Trong đó:
+ [A], [B], [C], [D] là nồng độ mol của các chất A, B, C, D ở trạng thái cân bằng.
+ a, b, c, d là hệ số tỉ lượng của các chất trong phương trình hóa học của phản ứng.
- Ví dụ: Xét phản ứng: C(s) + CO2(g) 2CO(g)
2. Ý nghĩa của biểu thức hằng số cân bằng
- Hằng số cân bằng KC phụ thuộc vào bản chất của phản ứng và nhiệt độ.
- KC càng lớn thì phản ứng thuận càng chiếm ưu thế và ngược lại.
III. Ảnh hưởng của nhiệt độ, nồng độ và áp suất đến cân bằng hóa học
1. Ảnh hưởng của nhiệt độ tới cân bằng hóa học
- Khi nhiệt độ tăng, cân bằng chuyển dịch theo chiều làm giảm nhiệt độ, tức là chiều phản ứng thu nhiệt, nghĩa là chiều làm giảm tác động của tăng nhiệt độ và ngược lại.
2. Nguyên lí chuyển dịch cân bằng Le Chatelier
- Khi tăng nồng độ một chất trong phản ứng thì cân bằng hóa học bị phá vỡ và chuyển dịch theo chiều làm giảm nồng độ của chất đó và ngược lại.
- Khi tăng áp suất chung của hệ, thì cân bằng chuyển dịch theo chiều làm giảm áp suất, tức là chiều làm giảm số mol khí và ngược lại.
- Nguyên lí chuyển dịch cân bằng Le Chatelier: Một phản ứng thuận nghịch đang ở trạng thái cân bằng, khi chịu một tác động bên ngoài như biến đổi nồng độ, nhiệt độ, áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.
Sơ đồ tư duy Mở đầu về cân bằng hoá học
Xem thêm lời giải bài tập Hóa học lớp 11 Cánh diều hay, chi tiết khác:
Bài 2: Sự điện li trong dung dịch nước. Thuyết Br∅nsted – Lowry về acid - base
Bài 3: PH của dung dịch. Chuẩn độ acid – base
Xem thêm các chương trình khác:
- Soạn văn lớp 11 Cánh diều (hay nhất)
- Văn mẫu lớp 11 - Cánh diều
- Tóm tắt tác phẩm Ngữ văn 11 – Cánh diều
- Tác giả tác phẩm Ngữ văn 11 - Cánh diều
- Giải SBT Ngữ văn 11 – Cánh diều
- Bố cục tác phẩm Ngữ văn 11 – Cánh diều
- Giải Chuyên đề học tập Ngữ văn 11 – Cánh diều
- Nội dung chính tác phẩm Ngữ văn lớp 11 – Cánh diều
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 – Cánh diều
- Giải Chuyên đề học tập Toán 11 – Cánh diều
- Lý thuyết Toán 11 - Cánh diều
- Giải sbt Toán 11 – Cánh diều
- Giải sgk Tiếng Anh 11 – ilearn Smart World
- Giải sbt Tiếng Anh 11 - ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh 11 ilearn Smart World đầy đủ nhất
- Giải sgk Vật lí 11 – Cánh diều
- Lý thuyết Vật lí 11 – Cánh diều
- Giải sbt Vật lí 11 – Cánh diều
- Giải Chuyên đề học tập Vật lí 11 – Cánh diều
- Giải sgk Sinh học 11 – Cánh diều
- Lý thuyết Sinh học 11 – Cánh diều
- Giải Chuyên đề học tập Sinh học 11 – Cánh diều
- Giải sbt Sinh học 11 – Cánh diều
- Giải sgk Giáo dục Kinh tế và Pháp luật 11 – Cánh diều
- Giải Chuyên đề học tập Kinh tế pháp luật 11 – Cánh diều
- Lý thuyết Kinh tế pháp luật 11 – Cánh diều
- Giải sbt Kinh tế pháp luật 11 – Cánh diều
- Giải sgk Lịch sử 11 – Cánh diều
- Giải Chuyên đề học tập Lịch sử 11 – Cánh diều
- Lý thuyết Lịch sử 11 - Cánh diều
- Giải sbt Lịch sử 11 – Cánh diều
- Giải sgk Địa lí 11 – Cánh diều
- Giải Chuyên đề học tập Địa lí 11 – Cánh diều
- Lý thuyết Địa lí 11 - Cánh diều
- Giải sbt Địa lí 11 – Cánh diều
- Giải sgk Công nghệ 11 – Cánh diều
- Lý thuyết Công nghệ 11 - Cánh diều
- Giải sbt Công nghệ 11 – Cánh diều
- Giải sgk Tin học 11 – Cánh diều
- Giải Chuyên đề học tập Tin học 11 – Cánh diều
- Lý thuyết Tin học 11 - Cánh diều
- Giải sbt Tin học 11 – Cánh diều
- Giải sgk Giáo dục quốc phòng an ninh 11 – Cánh diều
- Lý thuyết Giáo dục quốc phòng 11 – Cánh diều
- Giải sbt Giáo dục quốc phòng 11 – Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 – Cánh diều