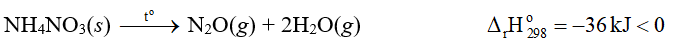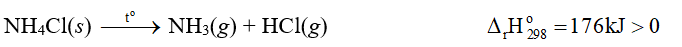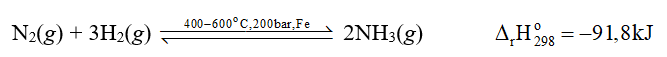Giải Hóa 11 Bài 5 (Cánh diều): Một số hợp chất quan trọng của nitrogen
Với giải bài tập Hóa 11 Bài 5: Một số hợp chất quan trọng của nitrogen sách Cánh diều hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 11 Bài 5.
Giải Hóa 11 Bài 5: Một số hợp chất quan trọng của nitrogen
Lời giải:
Có thể nhận biết sự có mặt của ion ammonium trong các ao tù bằng các cách:
+ Quan sát: Sự gia tăng nguyên tố dinh dưỡng N trong nước dẫn đến hệ quả vi khuẩn, rong, rêu, tảo … sinh sôi, nảy nở và phát triển rất mạnh.
+ Cho nước ao tù tác dụng với dung dịch kiềm, đun nóng: Nếu có mặt của ion ammonium sẽ sinh ra khí amonia (NH3) có mùi khai và xốc. Ngoài ra khí này có thể làm xanh giấy quỳ ẩm.
NH4+ + OH- → NH3 + H2O
I. Ammonia
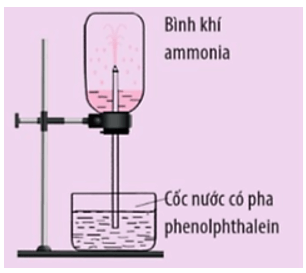
Luyện tập 1 trang 31 Hoá học 11: Cho thí nghiệm được thiết kế như hình dưới đây:
Trong thí nghiệm này, nước pha phenolphthalein sẽ bị hút lên bình chứa khí ammonia và phun thành những tia màu hồng. Hãy giải thích hiện tượng trên.
Lời giải:
- Nước pha phenolphthalein sẽ bị hút lên bình chứa khí ammonia và phun thành tia do khí ammonia tan nhiều trong nước (ở 20 oC, 1 bar, 1 lít nước có thể hoà tan 700 lít khí ammonia) làm giảm áp suất trong bình và nước bị hút vào bình.
- Nước phun thành tia màu hồng do dung dịch ammonia có tính base.
Lời giải:
Ammonia là một base theo thuyết Bronsted – Lowry. Do đó, khi giấy quỳ tím ẩm tiếp xúc với khí ammonia thì giấy quỳ ẩm sẽ chuyển sang màu xanh.
Lời giải:
Nhiệt độ hoá lỏng của N2, H2 và NH3 lần lượt là: -196 oC, - 252,87 oC, -33 oC.
Do đó, nếu giữ nguyên áp suất và làm lạnh thiết bị thì khí NH3 sẽ hoá lỏng đầu tiên.
II. Muối ammonium
Thực hành trang 33 Hoá học 11: Nhận biết ion ammonium
Chuẩn bị: Phân đạm ammonium chloride, dung dịch NaOH; ống nghiệm, đèn cồn, giấy quỳ.
Yêu cầu: Quan sát hiện tượng, viết phương trình hoá học của phản ứng đã xảy ra.
Lời giải:
Hiện tượng: Khi đun nóng hỗn hợp phân đạm ammonium chloride và kiềm (NaOH) thấy sinh ra khí có mùi khai và xốc. Khí này làm xanh giấy quỳ tím ẩm.
Phương trình hoá học:
NH4Cl(s) + NaOH(aq) NaCl(aq) + NH3(g) + H2O(l).
a) Cho biết các chất thường được sử dụng trong túi chườm lạnh.
b) Giải thích nguyên nhân giúp túi chườm lạnh có nhiệt độ thấp.
Lời giải:
a) Các chất thường được sử dụng trong túi chườm lạnh: nước, muối ammonium (như NH4Cl).
b) Muối ammonium (ví dụ NH4Cl rắn) khi hòa vào nước cất sẽ xảy ra quá trình:
NH4Cl (s) → NH4Cl (aq)
Quá trình này thu nhiệt, được ứng dụng rộng rãi trong việc sản xuất các túi chườm, giúp giảm đau, giảm viêm do các chấn thương.
Túi chườm hoạt động khi phá vỡ lớp ngăn cách giữa muối ammonium chloride và nước cất.
Lời giải:
⇒ Phản ứng phân huỷ ammonium nitrate toả nhiệt.
⇒ Phản ứng phân huỷ ammonium chloride thu nhiệt.
Vậy muối ammonium nitrate có nguy cơ cháy nổ cao hơn trong quá trình lưu trữ.
III. Ứng dụng của ammonia và một số muối ammonium
Lời giải:
Tỉ lệ mol kết hợp giữa NH3 và H3PO4 để tạo ra diammonium hydrogenphosphate (NH4)2HPO4 là 2 : 1.
Phương trình hoá học của phản ứng: 2NH3 + H3PO4 → (NH4)2HPO4.
IV. Nguồn gốc của một số oxide của nitrogen trong không khí – mưa acid
Lời giải:
Các phương trình hoá học minh hoạ:
- Tác động của mưa acid đối với calcium carbonate trong núi đá vôi:
2H+ + CaCO3 → Ca2+ + CO2 + H2O.
- Tác động của mưa acid đối với kim loại sắt có trong thép:
2H+ + Fe → Fe2+ + H2.
V. Nitric acid
Lời giải:
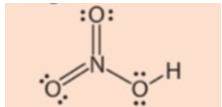
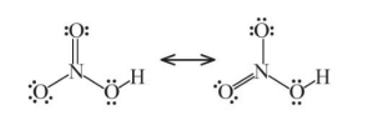
Câu hỏi 5 trang 36 Hoá học 11: Công thức Lewis của HNO3 như dưới đây có phù hợp không?
Lời giải:
Công thức Lewis của HNO3 theo đề bài là không phù hợp, do N ở chu kì 2, không có AO d trống.
Công thức Lewis của HNO3 là:
VI. Hiện tượng phú dưỡng
Lời giải:
Khi khơi thông nguồn nước thì nguy cơ xảy ra hiện tượng phú dưỡng sẽ giảm.
Do việc khơi thông nguồn nước sẽ giúp giảm sự tích tụ các chất dinh dưỡng trong nguồn nước, làm hạn chế sự sinh sôi, nảy nở của vi khuẩn, rong, rêu, tảo …
Lời giải:
Những dấu hiệu để dự đoán đã có hiện tượng phú dưỡng xảy ra trong một ao nước hay hồ nước:
+ Sự xuất hiện dày đặc của tảo xanh trong nước;
+ Nguồn thuỷ sản trong ao hồ bị suy kiệt;
+ Xuất hiện mùi hôi thối khó chịu…
Lời giải:
Để hạn chế nguy cơ xảy ra hiện tượng phú dưỡng trong hồ, ao, vuông … người nuôi thuỷ, hải sản nên:
+ Tạo điều kiện để nước trong hồ, ao, vuông … được lưu thông.
+ Lắp đặt thiết bị sục khí để khuấy trộn bề mặt ao và giúp giải phóng các loại khí như CO2.
+ Thường xuyên sử dụng chế phẩm vi sinh để tăng vi sinh có lợi cho hồ, ao, vuông …
Lời giải:
Hiện nay, địa phương em đẩy mạnh xây dựng các khu công nghiệp, do đó hiện tượng phú dưỡng tại các ao, hồ … xuất hiện ngày càng nhiều, chủ yếu là do việc thải nước thải chưa qua xử lí ra môi trường.
Một số biện pháp đề xuất để hạn chế hiện tượng này:
- Xử lí nước thải trước khi đổ vào ao, hồ….Tuyên truyền toàn dân chung sức ngăn chặn hành vi xả thải trái phép chưa qua xử lí ra môi trường. Báo cáo chính quyền xử lí khi thấy hiện tượng xả thải trái phép ra môi trường.
- Trồng một số thực vật thuỷ sinh phù hợp với môi trường phú dưỡng: bèo tây, ngổ trâu, cải xoong … Trồng thực vật thủy sinh cũng sẽ làm giảm mức độ dinh dưỡng trong nước ao, hồ và do đó không khuyến khích sự nhân lên của thực vật phù du.
- Lắp đặt các hệ thống sục khí ở các ao, hồ lớn … bị xả thải…
Lời giải:
Gần đây, mỗi năm có khoảng hàng trăm triệu tấn ammonia được sản xuất trên toàn cầu. Trong đó, có khoảng 80% được sử dụng để sản xuất phân đạm ammonium, urea … để cung cấp nguyên tố nitrogen cho đất và cây trồng. Ví dụ phản ứng dưới đây dùng để tổng hợp ra phân bón với thành phần chính là ammonium sulfate:
2NH3(aq) + H2SO4(aq) → (NH4)2SO4(aq)
Vì thế có thể nói ammonia có vai trò rất quan trọng đối với nông nghiệp.
Lời giải:
phản ứng thuận toả nhiệt. Tuy nhiên, khi thực hiện phản ứng ở nhiệt độ quá thấp thì tốc độ của phản ứng nhỏ, phản ứng diễn ra chậm. Thực tế, người ta đã chọn nhiệt độ phù hợp, khoảng 400 oC – 600 oC.
a) Hãy tính nồng độ mol của ammonia có trong buồng phản ứng tại thời điểm cân bằng.
b) Làm thế nào để tách được ammonia ra khỏi hỗn hợp?
Lời giải:
Ban đầu: a b 0 M
Phản ứng: x 3x 2x M
Cân bằng: 0,0201 0,0602 2x M
Áp dụng công thức có:
b) Tại thời điểm cân bằng, nồng độ ammonia, nitrogen và hydrogen trong buồng phản ứng là không đổi. Khi đó hỗn hợp khí này được dẫn qua hệ thống làm lạnh để hoá lỏng ammonia và tách ra khỏi hỗn hợp.
2CO(g) + 2NO(g) → 2CO2(g) +N2(g)
a) Cho biết ý nghĩa của phản ứng trên đối với môi trường.
b) Trong phản ứng trên, chất nào là chất oxi hoá, chất nào là chất khử? Giải thích.
c) Giá trị enthalpy tạo thành chuẩn của CO(g), NO(g), CO2(g) lần lượt là –110,5; 91,3; –393,5 (kJ mol-1). Hãy tính biến thiên enthalpy chuẩn của phản ứng trên. Phản ứng trên có thuận lợi về mặt năng lượng không? Giải thích.
Lời giải:
a) Ý nghĩa của phản ứng: 2CO(g) + 2NO(g) → 2CO2(g) + N2(g) đối với môi trường là giảm khí độc CO, giảm tác nhân gây mưa acid NO phát sinh từ quá trình đốt cháy nhiên liệu.
b)
Số oxi hoá của carbon tăng từ +2 lên +4 sau phản ứng nên CO đóng vai trò là chất khử.
Số oxi hoá của nitrogen giảm từ +2 xuống 0 sau phản ứng nên NO đóng vai trò là chất oxi hoá.
c)
= 2. (-393,5) + 0 – 2.(-110,5) – 2.91,3 = -748,6 (kJ) < 0.
Vậy phản ứng này toả nhiệt, thuận lợi về mặt năng lượng.
Bài tập 5 trang 38 Hoá học 11: Viết sơ đồ phản ứng gây ra mưa chứa nitric acid và sulfuric acid.
Lời giải:
- Sơ đồ phản ứng gây ra mưa chứa nitric acid:
Các phương trình hoá học minh hoạ cho sơ đồ:
N2(g) + O2(g) 2NO(g)
2NO(g) + O2(g) → 2NO2(g)
4NO2(g) + 2H2O(l) + O2(g) → 4HNO3(aq)
HNO3 → H+ + NO3-
- Sơ đồ phản ứng gây ra mưa chứa sulfuric acid:
Các phương trình hoá học minh hoạ cho sơ đồ:
SO2 + H2O → H2SO3
SO3 + H2O → H2SO4.
Lời giải:
- Một số hoạt động tạo thành các khí gây mưa acid tại địa phương em: khí thải của phương tiện giao thông; khí thải của nhà máy chưa qua xử lí ra môi trường; khí thải do đốt rác, đốt than …
- Một số biện pháp giảm thiểu sự tạo thành các khí này:
+ Tăng cường sử dụng xe đạp, phương tiện công cộng thay cho các phương tiện động cơ cá nhân như ô tô, xe máy …
+ Tăng cường sử dụng các nguồn năng lượng mới, năng lượng sạch, năng lượng tái tạo;
+ Sử dụng tiết kiệm, hiệu quả nguồn tài nguyên thiên nhiên;
+ Cải tiến công nghệ sản xuất, có biện pháp xử lí khí thải và tái chế các sản phẩm phụ có chứa sulfur.
Lý thuyết Một số hợp chất quan trọng của nitrogen
I. Ammonia
1. Cấu tạo phân tử và tính chất vật lí
- Cấu tạo phân tử:
+ Được cấu tạo bởi một nguyên tử nitrogen liên kết với ba nguyên tử hydrogen và có dạng hình học là chóp tam giác.
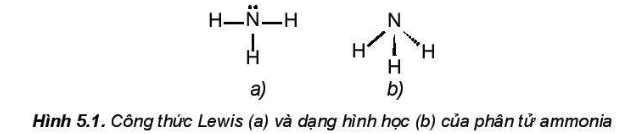
- Tính chất vật lí:
+ Ammonia tồn tại ở cả trong môi trường đất, nước, không khí.
+ Ở điều kiện thường, ammonia tồn tại ở thể khí, không màu, nhẹ hơn không khí, mùi khai và xốc, tan nhiều trong nước.
2. Tính chất hóa học
a, Tính base
- Trong dung dịch, nhận proton của nước: NH3 + H2O ⇌ NH4+ + OH-
- Có môi trường base yếu:
+ Làm quỳ tím chuyển màu xanh.
+ Làm phenolphtalein chuyển màu hồng.
- Thể hiện tính chất của một base: NH3 + HCl → NH4Cl
b, Tính khử
4NH4 + 3O2 → 2N2 + 6H2O
4NH3 + 5O2 → 4NO + 6H2O
3. Tổng hợp ammonia theo quá trình Haber
PTHH:
N2 + 3H2 ⇌ 2NH3
( nhiệt độ 400-450oC, áp suất 150-200 bar, xúc tác Fe)
II. Muối ammonium
1. Tính tan, sự điện li
- Hầu hết các muối ammonium đều dễ tan trong nước và phân li hoàn toàn ra ion.
VD: NH4Cl → NH4+ + Cl-
2. Tác dụng với kiềm – Nhận biết ion ammonuim
- Đun nóng hỗn hợp muối ammonium với dung dịch kiềm, sinh ra khí ammonia có mùi khai.
VD: NH4Cl + NaOH → NH3 + NaCl + H2O
Phương trình ion rút gọn: NH4+ + OH- → NH3 + H2O.
3. Tính chất kém bền nhiệt
- Các muối ammonuin đều kém bền nhiệt và dễ bị phân hủy khi đun nóng.
VD: NH4Cl → NH3 + HCl
III. Ứng dụng của ammonia và một số muối ammonium
- Ứng dụng của ammonia:
+ Tác nhận làm lạnh.
+ Dung môi.
+ Sản xuất nitric acid.
+ Sản xuất phân đạm.
- Ứng dụng của một số muối ammonium:
+ Chất đánh sạch bề mặt kim loại.
+ Thuốc long đờm.
+ Phân bón hóa học.
+ Chất phụ gia thực phẩm.
+ Thuốc bổ sung chất điện giải.
IV. Nguồn gốc một số oxide của nitrogen trong không khí – mưa acid
1. Nguồn gốc một số oxide của nitrogen
- Bầu khí quyển có oxide của nitrogen NOx.
- NO trong khí quyển được tạo ra khi có sấm sét.
- Hoạt động của con người.
2. Mưa acid
- Nguyên nhân chính: acid nitric và sulfuric acid hòa tan trong nước mưa.
- HÌnh thành:
SO2(g) + O2(g) → SO3(g)
SO3(g) + H2O(l) → H2So4(aq)
V. Nitric acid
Công thức Lewis:
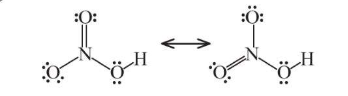
- Nitric acid là chất lỏng, không màu, có tính acid mạnh và tính oxi hóa mạnh
VI. Hiện tượng phú dưỡng
- Khái niệm: Hiện tượng phú dưỡng là sự tích tụ lớn các chất dinh dưỡng, bao gồm cả hợp chất nitrogen và hợp chất phosphorus trong các nguồn nước, do các tác động từ con người.
- Hệ quả: Làm thay đổi hệ sinh thái của nước, tích tụ bùn từ xác của tảo, làm suy kiệt nguồn thủy sản.
- Biện pháp:
+ Tạo điều kiện để nước trong kênh rạch, ao, hồ được lưu thông.
+ Xử lí nước thải trước khi cho chảy vào kênh, rạch, ao, hồ.
+ Sử dụng phân bón đúng liều lượng, đúng cách, đúng thời điểm trong năm.
Sơ đồ tư duy Một số hợp chất quan trọng của nitrogen

Xem thêm lời giải bài tập Hóa học lớp 11 Cánh diều hay, chi tiết khác:
Bài 6: Sulfur và sulfur dioxide
Bài 7: Sulfuric acid và muối sulfate
Bài 8: Hợp chất hữu cơ và hoá học hữu cơ
Xem thêm các chương trình khác:
- Soạn văn lớp 11 Cánh diều (hay nhất)
- Văn mẫu lớp 11 - Cánh diều
- Tóm tắt tác phẩm Ngữ văn 11 – Cánh diều
- Tác giả tác phẩm Ngữ văn 11 - Cánh diều
- Giải SBT Ngữ văn 11 – Cánh diều
- Bố cục tác phẩm Ngữ văn 11 – Cánh diều
- Giải Chuyên đề học tập Ngữ văn 11 – Cánh diều
- Nội dung chính tác phẩm Ngữ văn lớp 11 – Cánh diều
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 – Cánh diều
- Giải Chuyên đề học tập Toán 11 – Cánh diều
- Lý thuyết Toán 11 - Cánh diều
- Giải sbt Toán 11 – Cánh diều
- Giải sgk Tiếng Anh 11 – ilearn Smart World
- Giải sbt Tiếng Anh 11 - ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh 11 ilearn Smart World đầy đủ nhất
- Giải sgk Vật lí 11 – Cánh diều
- Lý thuyết Vật lí 11 – Cánh diều
- Giải sbt Vật lí 11 – Cánh diều
- Giải Chuyên đề học tập Vật lí 11 – Cánh diều
- Giải sgk Sinh học 11 – Cánh diều
- Lý thuyết Sinh học 11 – Cánh diều
- Giải Chuyên đề học tập Sinh học 11 – Cánh diều
- Giải sbt Sinh học 11 – Cánh diều
- Giải sgk Giáo dục Kinh tế và Pháp luật 11 – Cánh diều
- Giải Chuyên đề học tập Kinh tế pháp luật 11 – Cánh diều
- Lý thuyết Kinh tế pháp luật 11 – Cánh diều
- Giải sbt Kinh tế pháp luật 11 – Cánh diều
- Giải sgk Lịch sử 11 – Cánh diều
- Giải Chuyên đề học tập Lịch sử 11 – Cánh diều
- Lý thuyết Lịch sử 11 - Cánh diều
- Giải sbt Lịch sử 11 – Cánh diều
- Giải sgk Địa lí 11 – Cánh diều
- Giải Chuyên đề học tập Địa lí 11 – Cánh diều
- Lý thuyết Địa lí 11 - Cánh diều
- Giải sbt Địa lí 11 – Cánh diều
- Giải sgk Công nghệ 11 – Cánh diều
- Lý thuyết Công nghệ 11 - Cánh diều
- Giải sbt Công nghệ 11 – Cánh diều
- Giải sgk Tin học 11 – Cánh diều
- Giải Chuyên đề học tập Tin học 11 – Cánh diều
- Lý thuyết Tin học 11 - Cánh diều
- Giải sbt Tin học 11 – Cánh diều
- Giải sgk Giáo dục quốc phòng an ninh 11 – Cánh diều
- Lý thuyết Giáo dục quốc phòng 11 – Cánh diều
- Giải sbt Giáo dục quốc phòng 11 – Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 – Cánh diều