Giải Hóa 11 Bài 12 (Cánh diều): Alkane
Với giải bài tập Hóa 11 Bài 12: Alkane sách Cánh diều hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 11 Bài 12.
Giải Hóa 11 Bài 12: Alkane
Lời giải:
Trong phân tử alkane chỉ có các liên kết σ bền và kém phân cực. Mỗi nguyên tử carbon cũng như hydrogen đã tạo ra số liên kết cộng hoá trị lớn nhất của chúng. Vì thế, các alkane khó tham gia vào các phản ứng hoá học và các phản ứng xảy ra sẽ kèm theo việc thay thế nguyên tử hydrogen hoặc bẻ gẫy mạch carbon.
I. Khái niệm và danh pháp
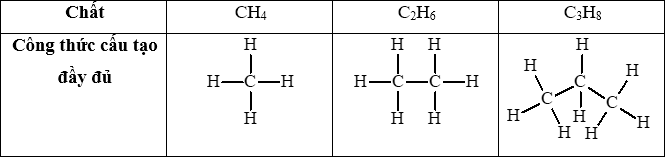
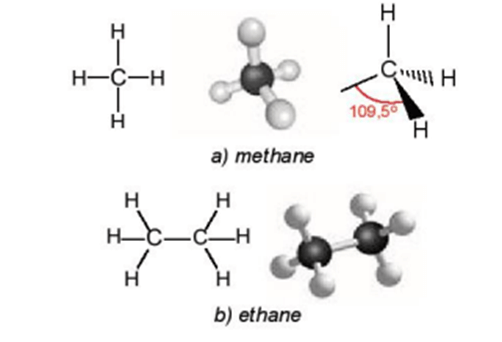
Câu hỏi 1 trang 73 Hóa học 11: Mô tả hình dạng của phân tử methane và ethane.
Lời giải:
- Trong phân tử methane, bốn liên kết C – H giống nhau tạo với nhau 1 góc 109,5o và hướng về 4 đỉnh của hình tứ diện đều.
- Trong phân tử ethane, mỗi nguyên tử C tạo được 4 liên kết đơn hướng từ nguyên tử C (nằm ở tâm của hình tứ diện) về 4 đỉnh của một tứ diện với góc liên kết khoảng 109,5o.
Lời giải:
III. Tính chất hoá học
Thí nghiệm 1 trang 76 Hóa học 11: Phản ứng của hexane với bromine
Chuẩn bị: Hexane, nước bromine; ống nghiệm, cốc nước nóng và bông tẩm dung dịch NaOH.
Chú ý an toàn: Hexane, bromine và hydrogen bromide dễ bay hơi, có mùi xốc, độc.
Lời giải:
Ban đầu ống nghiệm có hai lớp, lớp dưới là bromine màu vàng, lớp trên là hexane không màu.
Sau khi đặt ống nghiệm vào cốc nước nóng, thu được hỗn hợp không có màu.
Thí nghiệm 2 trang 76 Hóa học 11: Tác dụng của potassium permanganate với hexane
Chuẩn bị: Hexane, dung dịch KMnO4 1%; ống nghiệm.
Yêu cầu: Quan sát, nhận xét màu sắc và tính đồng nhất của hỗn hợp phản ứng.
Lời giải:
Quan sát thấy ống nghiệm có 2 lớp, lớp dưới là dung dịch KMnO4 trong nước màu tím, lớp trên là hexane không màu.
Thí nghiệm 3 trang 78 Hóa học 11: Đốt cháy hexane
Chuẩn bị: Hexane; chén sứ, que đóm dài, diêm hoặc bật lửa.
Tiến hành: Cho khoảng 1 mL hexane vào chén sứ, dùng que đóm dài để châm lửa đốt hexane.
Chú ý an toàn: Hexane bay hơi mạnh, dễ bắt lửa và cháy.
Lời giải:
Hexane bốc cháy cho ngọn lửa màu vàng.
Phương trình hoá học của phản ứng:
Lời giải:
Sử dụng biogas mang lại các lợi ích:
- Tránh được mầm bệnh cho vật nuôi, tận dụng được nguồn phân bón, thu được khí gas.
- Giải phóng sức lao động cho nội trợ.
- Giữ được môi trường xanh sạch đẹp.
- Tiết kiệm được chi phí hàng tháng.
IV. Nguồn alkane trong tự nhiên, ứng dụng của alkane
Lời giải:
Sử dụng biogas mang lại các lợi ích:
- Tránh được mầm bệnh cho vật nuôi, tận dụng được nguồn phân bón, thu được khí gas.
- Giải phóng sức lao động cho nội trợ.
- Giữ được môi trường xanh sạch đẹp.
- Tiết kiệm được chi phí hàng tháng.
A. Đưa thêm hợp chất có chứa chì vào xăng để làm tăng chỉ số octane của xăng.
B. Đưa thêm chất xúc tác vào ống xả động cơ để chuyển hoá các khí thải độc.
D.Tổ chức thu gom và xử lí dầu cặn.
Lời giải:
Đáp án đúng là: A
Biện pháp A không làm giảm ô nhiễm môi trường do lượng chì trong xăng cao là nguyên nhân gây ô nhiễm không khí.
Lời giải:
Một số biện pháp góp phần làm giảm ô nhiễm môi trường do các phương tiện giao thông gây ra:
- Giảm bớt lượng chì (lead) có trong nhiên liệu.
- Tăng hiệu suất đốt cháy nhiên liệu động cơ.
- Đưa thêm chất xúc tác vào ống xả động cơ nhằm tiếp tục chuyển hoá alkane trong khí thải động cơ thành carbon dioxide và nước.
- Trồng nhiều cây xanh.
Bài tập (trang 80)
Lời giải:
CH3 – CH2 – CH2 – CH2 – CH3: pentane.
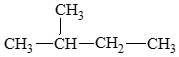
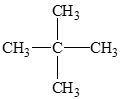
Lời giải:
Không dùng nước để dập các đám cháy xăng, dầu mà phải dùng cát hoặc các bình chứa khí CO2 là vì: xăng, dầu nhẹ hơn nước; khi dùng nước để dập đám cháy thì xăng, dầu sẽ nổi lên trên mặt nước, lan rộng theo nước tràn làm cho đám cháy trở lên mãnh liệt hơn. Còn khi sử dụng cát hoặc bình chứa khí CO2 thì sẽ ngăn cản xăng, dầu tiếp xúc với oxygen không khí làm cho đám cháy bị dập tắt.
a) Vì sao khó thu được hydrocarbon tinh khiết bằng cách chưng cất dầu thô?
Lời giải:
a) Khó thu được hydrocarbon tinh khiết bằng cách chưng cất dầu thô do trong dầu thô có nhiều hydrocarbon có nhiệt độ sôi gần nhau.
b) Phương trình hoá học:
C11H24 C5H12 + C6H12.
Lời giải:
Khí thải của động cơ có thể chứa các chất gây ô nhiễm môi trường như: carbon dioxide; carbon monoxide; các oxide của nitrogen (sinh ra từ phản ứng của oxygen với nitrogen không khí), alkane chưa cháy hết.
Một số giải pháp để hạn chế ô nhiễm môi trường do khí thải của động cơ:
- Giảm bớt lượng chì (lead) có trong nhiên liệu.
- Tăng hiệu suất đốt cháy nhiên liệu động cơ.
- Đưa thêm chất xúc tác vào ống xả động cơ nhằm tiếp tục chuyển hoá alkane trong khí thải động cơ thành carbon dioxide và nước.
- Trồng nhiều cây xanh.
Lý thuyết Alkane
1. Khái niệm về Alkane
a. Tìm hiểu nguồn Alkane trong tự nhiên
- Bề mặt những vùng đầm lầy thường xuất hiện các bong bóng khí, đó là alkane đơn giản nhất
- Có tên gọi methane
- Dấu mỏ trong tự nhiên cũng chứa thành phần chính là các alkane.
b. Tìm hiểu cấu tạo và công thức chung của alkane
- Alkane không phân nhánh có mạch carbon chứa nguyên tử carbon bậc I và bậc II
- Alkane phân nhánh có chứa nguyên tử carbon bạc III, bậc IV.
=> Alkane là những hydrocarbon mạch hở, chứa liên kết đơn
- Có công thức chung: CnH2n+2 (n ≥ 1)
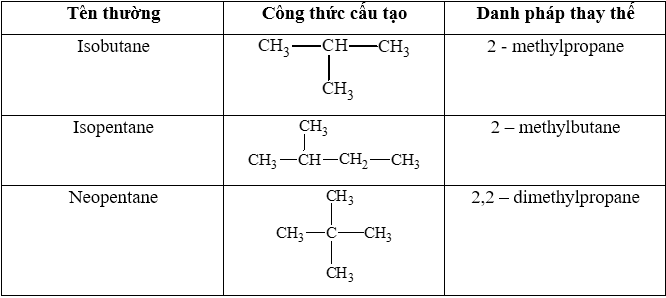
2. Danh pháp Alkane
- Tên theo danh pháp của alkane không phân nhánh:
![]()
- Tên theo danh pháp của alkane phân nhánh:
![]()
+ Chọn mạch chính là mạch carbon dài nhất
+ Tên nhánh là tên gốc alkyl
3. Tính chất vật lí
- Ở điều kiện thường, các alkane từ C1 đến C4 và neopentan ở thể khí
- Các alkane có nhiều nguyên tử carbon hơn ở thể lỏng hoặc rắn.
- Các alkane đều nhẹ hơn nước.
- Do các phân tử alkane không phân cực nên alkane không tan trong nước nhưng tan tốt trong các dung môi không phân cực.
4. Tính chất hóa học
a. Tìm hiểu đặc điểm liên kết hóa học trong phân tử alkane
- Mỗi nguyên tử carbon trong alkane đều nằm ở tâm của một tứ diện
- alkane tương đối trơ về mặt hóa học
b. Tìm hiểu tính chất hóa học của alkane
* Phản ứng thế Halogen
- Nguyên tử hydrogen liên kết với nguyên tử carbon bậc cao hơn, dễ vị thế bởi nguyên tử halogen so với nguyên tử hydrogen
- Các sản phẩm thế halogen của hydrocarbon được gọi là dẫn xuất halogen của hydrocarbon
Ví dụ:
C6H14 + Cl2 ―1:1, ánh sáng→ C6H13Cl + HCl
* Phản ứng Cacking
- Cracking alkane là quá trình “bẻ gãy” các phân tử alkane mạch dài thành cá phân tuwe hydrocarbon mạch ngắn hơn
Ví dụ:
C12H26 → C7H16 + C5H10
* Phản ứng reforming
- Là quá trình biến đổi cấu trúc phân tử các alkane mạch không phân nhánh, mạch hở, không thơm thành các hydrocarbon có mạch nhánh hoặc mạch vòng
* Phản ứng oxi hóa
- Oxi hóa hoàn toàn: các alkane thường dễ cháy và tỏa nhiệt nhiều nên nhiều alkane được dùng làm nhiên liệu
- Oxi hóa không hoàn toàn: Thiếu oxygen phản ứng cháy xảy ra không hoàn toàn → gây ô nhiễm môi trường
+ Alkane không làm mất màu dung dịch KMNO4
5. Ứng dụng của alkane và điều chế alkane trong công nghiệp
a. Tìm hiểu ứng dụng của alkane
- Alkane dùng làm nhiên liệu, dung môi, dầu nhờn,… và là nguyên liệu trong tổng hợp hữu cơ
b. Tìm hiểu điều chế alkane trong công nghiệp
- Alkane là thành phần chính của khí nhiên nhiêm, khí đồng hành và dầu mỏ
+ Từ khí thiên nhiên thu được: CH4, C2H6,…
+ Từ dầu mỏ bằng phương pháp chưng cất
c. Tìm hiểu một số nguyên nhân gây ô nhiễm không khí do các phương tiện giao thông, cách giảm thiểu và hạn chế
- Ô nhiễm không khí là một trong các nguyên nhân góp phần làm Trải Đất nóng lên và gây ra sự biến đổi khí hậu toàn cầu:
+ Khí thải do các phương tiện giao thông hoạt động thải ra
+ Khói thải và các hạt bụi mịn thải vào khí quyền là tác nhân gây ảnh hưởng nghiêm trọng đến sức khoẻ người dân.
- Biện pháp
+ Tăng cường hình thức vận tải công cộng
+ Giảm thiểu sự phụ thuộc nhiên liệu hoá thạch, tăng cường các nguồn nhiên liệu xanh, sạch như hydrogen, năng lượng mặt trời
+ Bảo vệ rừng
=> Là những cách giúp hạn chế sự ô nhiễm không khí
Xem thêm lời giải bài tập Hóa học lớp 11 Cánh diều hay, chi tiết khác:
Bài 9: Phương pháp tách biệt và tinh chế hợp chất hữu cơ
Bài 10: Công thức phân tử hợp chất hữu cơ
Xem thêm các chương trình khác:
- Soạn văn lớp 11 Cánh diều (hay nhất)
- Văn mẫu lớp 11 - Cánh diều
- Tóm tắt tác phẩm Ngữ văn 11 – Cánh diều
- Tác giả tác phẩm Ngữ văn 11 - Cánh diều
- Giải SBT Ngữ văn 11 – Cánh diều
- Bố cục tác phẩm Ngữ văn 11 – Cánh diều
- Giải Chuyên đề học tập Ngữ văn 11 – Cánh diều
- Nội dung chính tác phẩm Ngữ văn lớp 11 – Cánh diều
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 – Cánh diều
- Giải Chuyên đề học tập Toán 11 – Cánh diều
- Lý thuyết Toán 11 - Cánh diều
- Giải sbt Toán 11 – Cánh diều
- Giải sgk Tiếng Anh 11 – ilearn Smart World
- Giải sbt Tiếng Anh 11 - ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh 11 ilearn Smart World đầy đủ nhất
- Giải sgk Vật lí 11 – Cánh diều
- Lý thuyết Vật lí 11 – Cánh diều
- Giải sbt Vật lí 11 – Cánh diều
- Giải Chuyên đề học tập Vật lí 11 – Cánh diều
- Giải sgk Sinh học 11 – Cánh diều
- Lý thuyết Sinh học 11 – Cánh diều
- Giải Chuyên đề học tập Sinh học 11 – Cánh diều
- Giải sbt Sinh học 11 – Cánh diều
- Giải sgk Giáo dục Kinh tế và Pháp luật 11 – Cánh diều
- Giải Chuyên đề học tập Kinh tế pháp luật 11 – Cánh diều
- Lý thuyết Kinh tế pháp luật 11 – Cánh diều
- Giải sbt Kinh tế pháp luật 11 – Cánh diều
- Giải sgk Lịch sử 11 – Cánh diều
- Giải Chuyên đề học tập Lịch sử 11 – Cánh diều
- Lý thuyết Lịch sử 11 - Cánh diều
- Giải sbt Lịch sử 11 – Cánh diều
- Giải sgk Địa lí 11 – Cánh diều
- Giải Chuyên đề học tập Địa lí 11 – Cánh diều
- Lý thuyết Địa lí 11 - Cánh diều
- Giải sbt Địa lí 11 – Cánh diều
- Giải sgk Công nghệ 11 – Cánh diều
- Lý thuyết Công nghệ 11 - Cánh diều
- Giải sbt Công nghệ 11 – Cánh diều
- Giải sgk Tin học 11 – Cánh diều
- Giải Chuyên đề học tập Tin học 11 – Cánh diều
- Lý thuyết Tin học 11 - Cánh diều
- Giải sbt Tin học 11 – Cánh diều
- Giải sgk Giáo dục quốc phòng an ninh 11 – Cánh diều
- Lý thuyết Giáo dục quốc phòng 11 – Cánh diều
- Giải sbt Giáo dục quốc phòng 11 – Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 – Cánh diều