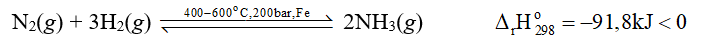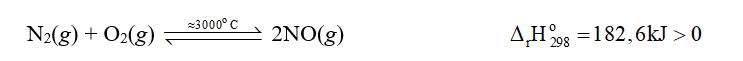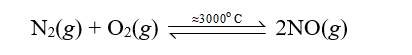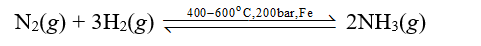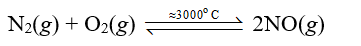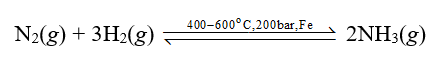Giải Hóa 11 Bài 4 (Cánh diều): Đơn chất nitrogen
Với giải bài tập Hóa 11 Bài 4: Đơn chất nitrogen sách Cánh diều hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 11 Bài 4.
Giải Hóa 11 Bài 4: Đơn chất nitrogen
Lời giải:
Người ta phải bơm khí nitrogen vào các khoang chứa của tàu chở dầu sau khi chuyển dầu ra khỏi khoang để làm giảm nồng độ của oxygen, giảm nguy cơ cháy nổ. Do tính chất kém hoạt động hoá học (tính trơ), nitrogen không oxi hoá các chất khác ở nhiệt độ thường.
I. Trạng thái tự nhiên của nguyên tố nitrogen
Lời giải:
Phát biểu “Nitrogen là nguyên tố đặc trưng cho sự sống” là một phát biểu đúng.
Nguyên tố nitrogen có trong cơ thể của mọi loại sinh vật chủ yếu ở dạng các hợp chất hữu cơ như amino acid, nucleic acid, protein, chlorophyll (chất diệp lục), … Các hợp chất này đóng vai trò quan trọng cho những quá trình sinh hoá của sinh vật.
II. Đơn chất nitrogen
b) Cho biết chất nào hoạt động hoá học hơn.
Lời giải:
a) Nguyên nhân dẫn đến sự khác biệt giá trị năng lượng liên kết giữa hai phân tử fluorine và nitrogen do:
- Giữa 2 nguyên tử fluorine trong phân tử F2 có liên kết đơn.
- Giữa 2 nguyên tử nitrogen trong phân tử N2 có liên kết ba.
b) Trong hai phân tử trên, fluorine hoạt động hơn do liên kết ba giữa hai nguyên tử N trong phân tử nitrogen có năng lượng liên kết rất lớn (946 kJ mol-1) nên rất khó bị phá vỡ.
Lời giải:
Vậy phản ứng giữa nitrogen với hydrogen là phản ứng toả nhiệt.
Vậy phản ứng giữa nitrogen với oxygen là phản ứng thu nhiệt.
⇒ Phản ứng giữa nitrogen với hydrogen diễn ra thuận lợi hơn.
Luyện tập 2 trang 27 Hoá học 11: Sử dụng kiến thức hoá học để giải thích câu ca dao sau:
Hễ nghe tiếng sấm, phất cờ mà lên”
Lời giải:
Khi có sấm sét, nitrogen và oxygen trong không khí phản ứng với nhau tạo thành nitrogen monoxide (NO):
Sau đó, nitrogen monoxide nhanh chóng bị oxi hoá bởi oxygen trong khí quyển tạo thành nitrogen dioxide (NO2):
2NO(g) + O2(g) → 2NO2(g)
Tiếp theo là quá trình nitrogen dioxide chuyển thành acid trong nước mưa, theo phản ứng:
4NO2(g) + 2H2O(l) + O2(g) → 4HNO3(aq)
Nước mưa với nồng độ acid phù hợp sẽ cũng cấp đạm cho đất ở dạng ion nitrate cần thiết cho cây trồng.
Lời giải:
Dự đoán ở nhiệt độ thường thì chlorine dễ phản ứng với hydrogen hơn. Do liên kết ba giữa hai nguyên tử N trong phân tử nitrogen có năng lượng liên kết rất lớn (946 kJ mol-1) nên rất khó bị phá vỡ.
Lời giải:
- Phản ứng của nitrogen với hydrogen:
Trong thực tế, phản ứng này được ứng dụng trong công nghiệp để sản xuất NH3 – nguyên liệu để sản xuất phân bón, nitric acid …
- Phản ứng của nitrogen với oxygen:
Trong khí quyển, phản ứng này chính là sự khởi đầu cho quá trình tạo thành ion nitrate, được coi là một nguồn cung cấp đạm tự nhiên cho đất.
a) Khi phản ứng đạt trạng thái cân bằng thì trong thiết bị sẽ có các khí nào?
Lời giải:
a) Do phản ứng thuận nghịch nên khi phản ứng đạt trạng thái cân bằng thì trong thiết bị sẽ có các khí: N2, H2 và NH3.
b) Nhiệt độ hoá lỏng của N2, H2 và NH3 lần lượt là: -196 oC, - 252,87 oC, -33 oC.
Do đó, nếu giữ nguyên áp suất và làm lạnh thiết bị thì khí NH3 sẽ hoá lỏng đầu tiên.
Lý thuyết Đơn chất nitrogen
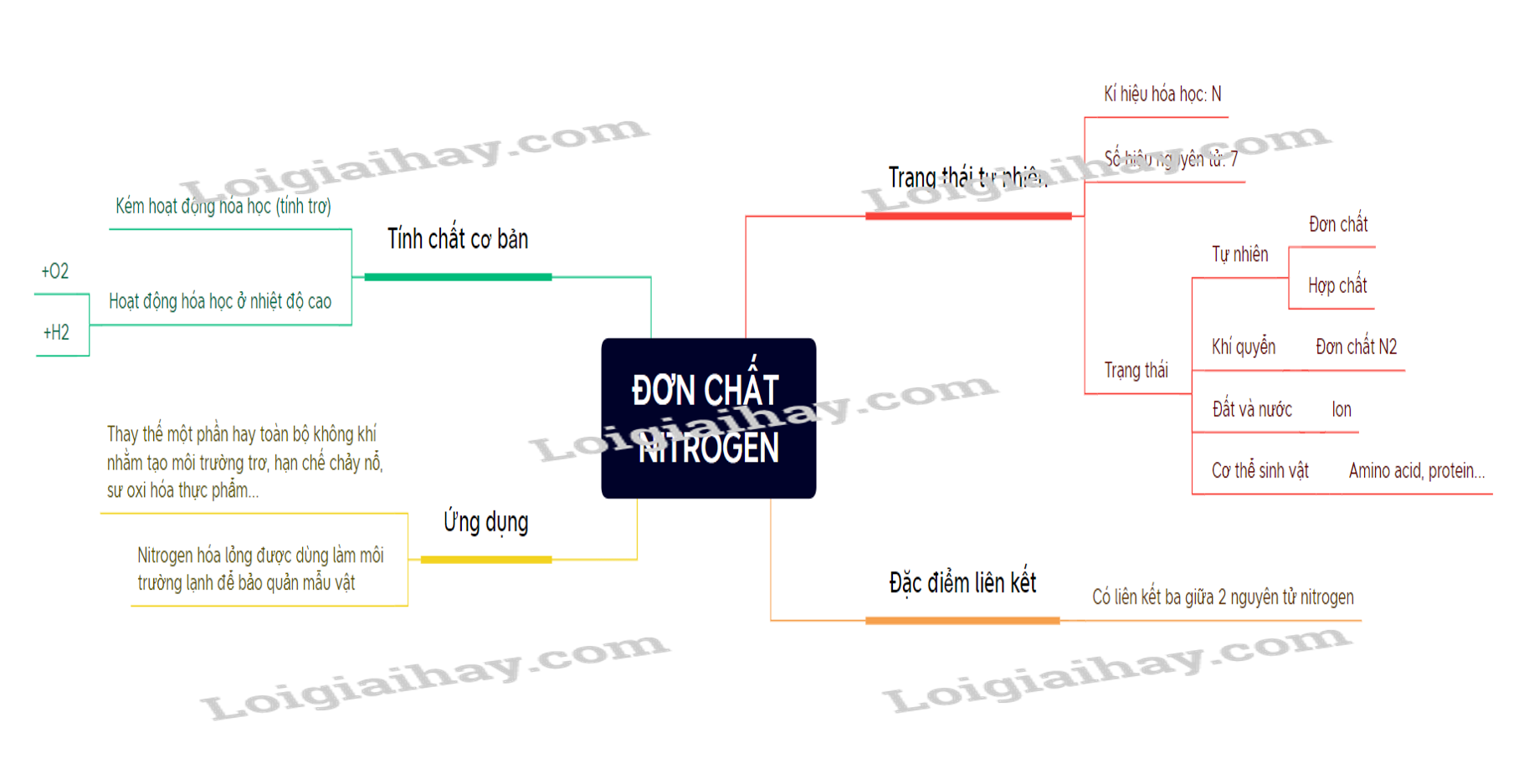
I. Trạng thái tự nhiên của nguyên tố Nitrogen
- Kí hiệu hóa học: N.
- Số hiệu nguyên tử: 7.
- Trong tự nhiên: tồn tại ở cả đơn chất và hợp chất.
- Trong khí quyển: chủ yếu dưới dạng đơn chất N2.
- Trong đất và nước: ion NO3-, NO2-, NH4+.
- Trong cơ thể sinh vật: amino acid, protein…
II. Đơn chất Nitrogen
1. Đặc điểm liên kết
- Phân tử N2 có liên kết ba giữa hai nguyên tử nitrogen.
2. Tính chất cơ bản
a, Tính kém hoạt động hóa học (tính trơ) ở nhiệt độ thấp
- Liên kết ba có năng lượng rất lớn ( 946 kj/mol) nên khó bị phá vỡ và tham gia phản ứng. Do vậy nên đơn chất nitrogen kém hoạt động hóa học.
b, Tính hoạt động hóa học ở nhiệt độ cao
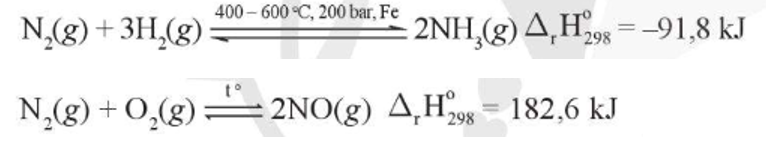
3. Ứng dụng
- Được sử dụng để thay thế một phần hay toàn bộ không khí nhằm tạo môi trường trơ, hạn chế cháy nổ, hạn chế sự oxi hóa thực phẩm…
- Nitrogen lỏng được dùng làm môi trường lạnh để bảo quản mẫu vật trong ý tế và nghiên cứu khoa học …
Sơ đồ tư duy Đơn chất nitrogen
Xem thêm lời giải bài tập Hóa học lớp 11 Cánh diều hay, chi tiết khác:
Bài 5: Một số hợp chất quan trọng của nitrogen
Bài 6: Sulfur và sulfur dioxide
Bài 7: Sulfuric acid và muối sulfate
Xem thêm các chương trình khác:
- Soạn văn lớp 11 Cánh diều (hay nhất)
- Văn mẫu lớp 11 - Cánh diều
- Tóm tắt tác phẩm Ngữ văn 11 – Cánh diều
- Tác giả tác phẩm Ngữ văn 11 - Cánh diều
- Giải SBT Ngữ văn 11 – Cánh diều
- Bố cục tác phẩm Ngữ văn 11 – Cánh diều
- Giải Chuyên đề học tập Ngữ văn 11 – Cánh diều
- Nội dung chính tác phẩm Ngữ văn lớp 11 – Cánh diều
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 – Cánh diều
- Giải Chuyên đề học tập Toán 11 – Cánh diều
- Lý thuyết Toán 11 - Cánh diều
- Giải sbt Toán 11 – Cánh diều
- Giải sgk Tiếng Anh 11 – ilearn Smart World
- Giải sbt Tiếng Anh 11 - ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh 11 ilearn Smart World đầy đủ nhất
- Giải sgk Vật lí 11 – Cánh diều
- Lý thuyết Vật lí 11 – Cánh diều
- Giải sbt Vật lí 11 – Cánh diều
- Giải Chuyên đề học tập Vật lí 11 – Cánh diều
- Giải sgk Sinh học 11 – Cánh diều
- Lý thuyết Sinh học 11 – Cánh diều
- Giải Chuyên đề học tập Sinh học 11 – Cánh diều
- Giải sbt Sinh học 11 – Cánh diều
- Giải sgk Giáo dục Kinh tế và Pháp luật 11 – Cánh diều
- Giải Chuyên đề học tập Kinh tế pháp luật 11 – Cánh diều
- Lý thuyết Kinh tế pháp luật 11 – Cánh diều
- Giải sbt Kinh tế pháp luật 11 – Cánh diều
- Giải sgk Lịch sử 11 – Cánh diều
- Giải Chuyên đề học tập Lịch sử 11 – Cánh diều
- Lý thuyết Lịch sử 11 - Cánh diều
- Giải sbt Lịch sử 11 – Cánh diều
- Giải sgk Địa lí 11 – Cánh diều
- Giải Chuyên đề học tập Địa lí 11 – Cánh diều
- Lý thuyết Địa lí 11 - Cánh diều
- Giải sbt Địa lí 11 – Cánh diều
- Giải sgk Công nghệ 11 – Cánh diều
- Lý thuyết Công nghệ 11 - Cánh diều
- Giải sbt Công nghệ 11 – Cánh diều
- Giải sgk Tin học 11 – Cánh diều
- Giải Chuyên đề học tập Tin học 11 – Cánh diều
- Lý thuyết Tin học 11 - Cánh diều
- Giải sbt Tin học 11 – Cánh diều
- Giải sgk Giáo dục quốc phòng an ninh 11 – Cánh diều
- Lý thuyết Giáo dục quốc phòng 11 – Cánh diều
- Giải sbt Giáo dục quốc phòng 11 – Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 – Cánh diều