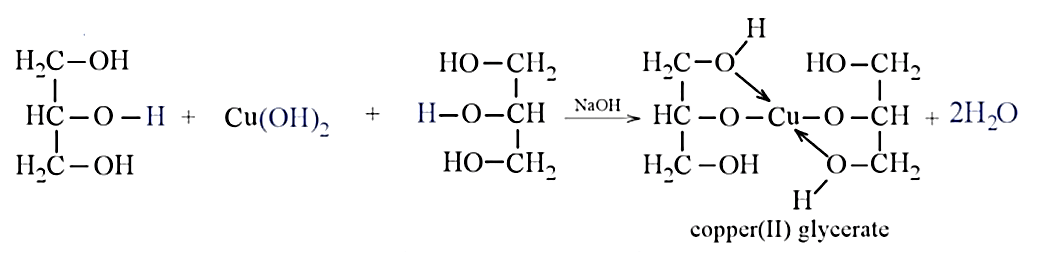Giải Hóa 11 Bài 17 (Cánh diều): Phenol
Với giải bài tập Hóa 11 Bài 17: Phenol sách Cánh diều hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 11 Bài 17.
Giải Hóa 11 Bài 17: Phenol
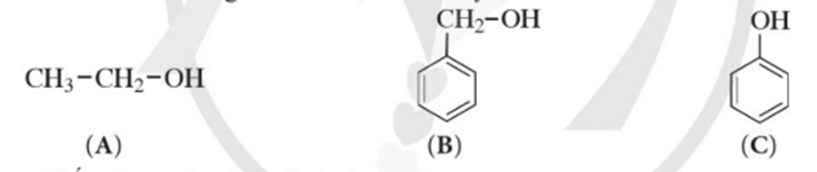
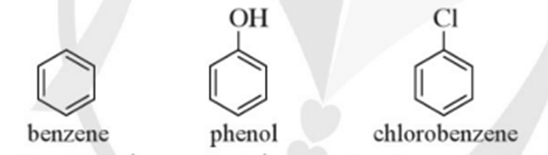
Mở đầu trang 116 Hóa học 11: Cho ba chất có công thức cấu tạo dưới đây:
a) Chất nào ở trên thuộc loại alcohol?
b) Hợp chất (C) có những đặc điểm cấu tạo nào khác so với hai hợp chất (A) và (B)?
c) Dự đoán tính chất hoá học của hợp chất (C) có khác (A) và (B) hay không.
Lời giải:
a) Chất (B) thuộc loại alcohol do có nhóm – OH liên kết trực tiếp với nguyên tử carbon no.
b) Hợp chất (C) khác hợp chất (A), (B) ở điểm: có nhóm – OH liên kết trực tiếp với nguyên tử carbon của vòng benzene.
c) Dự đoán: Tính chất hoá học của hợp chất (C) khác tính chất hoá học của các hợp chất (A) và (B).
I. Khái niệm
II. Tính chất vật lí
Lời giải:
Dự đoán nhiệt độ sôi các chất như sau:
|
Chất |
C6H5CH3 |
C6H5Cl |
C6H5OH |
|
Nhiệt độ sôi |
110 oC |
132 oC |
182 oC |
Giải thích:
- Do có nhóm – OH trong phân tử nên phenol tạo ra liên kết hydrogen giữa các phân tử. Do vậy, phenol có nhiệt độ sôi cao hơn C6H5Cl (có phân tử khối tương đương).
- Do liên kết C – Cl phân cực nên C6H5Cl có nhiệt độ sôi cao hơn C6H5CH3 (có phân tử khối tương đương).
Lời giải:
Trong phân tử phenol, nhóm – OH liên kết trực tiếp với vòng benzene. Chính nhờ có sự liên kết này, vòng benzene trở thành nhóm hút electron, làm giảm mật độ electron ở nguyên tử oxygen và tăng sự phân cực của liên kết O – H (so với trong phân tử alcohol); đồng thời làm tăng mật độ electron trong vòng benzene, nhất là ở các vị trí ortho và para.
Như vậy, tính acid của phenol mạnh hơn so với alcohol và phản ứng thế nguyên tử H của vòng benzene trong phân tử phenol xảy ra dễ hơn so với benzene.
Lời giải:
Các phương trình hoá học chứng minh tính acid của phenol mạnh hơn tính acid của alcohol:
C6H5OH + NaOH → C6H5ONa + H2O
C2H5OH + NaOH → không phản ứng
C6H5OH + Na2CO3 ⇌ C6H5ONa + NaHCO3
C2H5OH + Na2CO3 → không phản ứng.
III. Tính chất hoá học
Lời giải:
Trong phân tử phenol, nhóm – OH liên kết trực tiếp với vòng benzene. Chính nhờ có sự liên kết này, vòng benzene trở thành nhóm hút electron, làm giảm mật độ electron ở nguyên tử oxygen và tăng sự phân cực của liên kết O – H (so với trong phân tử alcohol); đồng thời làm tăng mật độ electron trong vòng benzene, nhất là ở các vị trí ortho và para.
Như vậy, tính acid của phenol mạnh hơn so với alcohol và phản ứng thế nguyên tử H của vòng benzene trong phân tử phenol xảy ra dễ hơn so với benzene.
Lời giải:
Các phương trình hoá học chứng minh tính acid của phenol mạnh hơn tính acid của alcohol:
C6H5OH + NaOH → C6H5ONa + H2O
C2H5OH + NaOH → không phản ứng
C6H5OH + Na2CO3 ⇌ C6H5ONa + NaHCO3
C2H5OH + Na2CO3 → không phản ứng.
Thí nghiệm 1 trang 119 Hóa học 11: Phản ứng của phenol và dung dịch NaOH
Chuẩn bị: Dung dịch phenol ở dạng huyền phù, dung dịch NaOH 1M; ống nghiệm.
Yêu cầu: Quan sát, mô tả hiện tượng xảy ra và giải thích.
Lời giải:
- Hiện tượng: Dung dịch phenol ở dạng huyền phù trở nên trong suốt sau phản ứng.
- Giải thích: Phenol phản ứng với NaOH thu được muối tan nên sau phản ứng dung dịch trở nên trong suốt. Phương trình hoá học minh hoạ:
C6H5OH + NaOH → C6H5ONa + H2O
Thí nghiệm 2 trang 119 Hóa học 11: Phản ứng của phenol với dung dịch Na2CO3
Yêu cầu: Quan sát, mô tả hiện tượng xảy ra và giải thích.
Lời giải:
- Hiện tượng: Dung dịch phenol ở dạng huyền phù trở nên trong hơn sau phản ứng.
- Giải thích: Phenol phản ứng với Na2CO3 thu được muối tan nên sau phản ứng dung dịch trở nên trong hơn. Phương trình hoá học minh hoạ:
C6H5OH + Na2CO3 ⇌ C6H5ONa + NaHCO3.
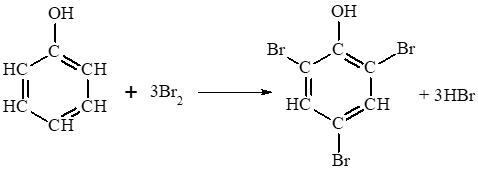
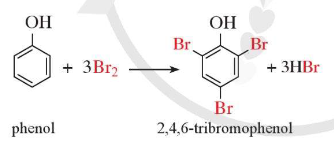
Thí nghiệm 3 trang 119 Hóa học 11: Phản ứng của phenol với nước bromine
Chuẩn bị: Dung dịch phenol 5%, nước bromine bão hoà, ống nghiệm.
Yêu cầu: Quan sát, mô tả hiện tượng xảy ra và giải thích.
Lời giải:
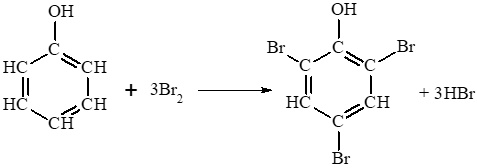
- Hiện tượng: Nước bromine mất màu và xuất hiện kết tủa trắng do phenol phản ứng với nước bromine tạo thành sản phẩm thế 2,4,6 – tribromophenol ở dạng kết tủa màu trắng.
Phương trình hoá học:
Lời giải:
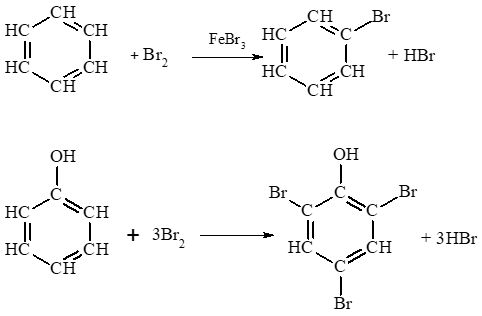
Benzene phản ứng với Br2 trong điều kiện đun nóng và có xúc tác FeBr3. Phenol phản ứng với Br2 ngay điều kiện thường và không cần chất xúc tác. Điều đó chứng tỏ do ảnh hưởng của nhóm – OH, phản ứng thế nguyên tử hydrogen ở vòng benzene của phenol xảy ra dễ dàng hơn so với benzene.
Phương trình hoá học chứng minh:
Lời giải:
- Đề xuất: Thuốc thử để nhận biết ống nghiệm chứa dung dịch phenol là dung dịch bromine.
- Cách nhận biết:
+ Đánh số thứ tự từng ống nghiệm mất nhãn, trích mẫu thử.
+ Cho lần lượt từng mẫu thử tác dụng với dung dịch bromine:
Nếu xuất hiện kết tủa trắng → mẫu thử là phenol.
Không có kết tủa xuất hiện → mẫu thử là propanol, benzene.
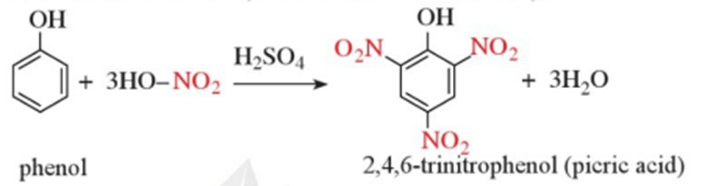
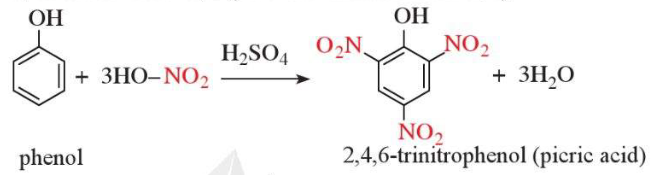
Thí nghiệm 4 trang 120 Hóa học 11: Phản ứng của phenol với nitric acid đặc
Theo dõi mô tả thí nghiệm sau.
Yêu cầu: Viết phương trình hóa học và giải thích hiện tượng xảy ra.
Lời giải:
Phenol phản ứng với dung dịch nitric acid đặc trong dung dịch sulfuric acid đặc tạo ra sản phẩm 2,4,6 – trinitrophenol (picric acid, dạng tinh thể màu vàng).
Phương trình hoá học:
IV. Ứng dụng và điều chế
Câu hỏi 2 trang 120 Hóa học 11: Hãy trình bày một số ứng dụng của phenol trong thực tiễn.
Lời giải:
Một số ứng dụng của phenol trong thực tiễn:
Phenol là nguyên liệu chính để sản xuất bisphenol A, một chất trung gian dùng trong sản xuất nhựa epoxy. Phenol cũng được sử dụng nhiều trong sản xuất nhựa phenol – formaldehyde hay poly(phenol – formaldehyde).
Phenol được dùng để sản xuất phẩm nhuộm, sản xuất thuốc nổ (2,4,6 – trinitrophenol), chất diệt cỏ 2,4 – D (2,4 – dichlorophenoxyacetic acid); chất diệt nấm mốc (các đồng phân của nitrophenol),…
Do có tính diệt khuẩn nên phenol được dùng làm chất khử trùng, tẩy uế. Thuốc xịt chloraseptic chứa 1,4% phenol được dùng làm thuốc chữa đau họng.
Bài tập (trang 121)
Bài 1 trang 121 Hóa học 11: Trong các chất có công thức sau, chất nào có nhiệt độ sôi cao nhất?
Lời giải:
Chất có nhiệt độ sôi cao nhất là phenol. Do có nhóm – OH trong phân tử nên phenol tạo ra liên kết hydrogen giữa các phân tử, benzene và chlorobenzene không tạo được liên kết hydrogen giữa các phân tử.
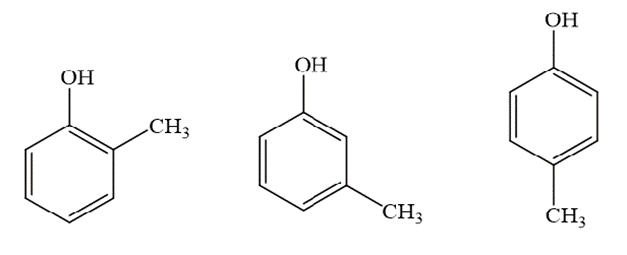
Lời giải:
Các chất chứa vòng benzene có cùng công thức phân tử C7H8O:
Lời giải:
Trích mẫu thử.
Cho từng mẫu thử tác dụng với dung dịch bromine.
+ Xuất hiện kết tủa trắng → dung dịch phenol.
+ Không có hiện tượng xuất hiện → dung dịch ethanol, dung dịch glycerol (nhóm I).
Cho lần lượt từng mẫu thử ở nhóm I tác dụng với Cu(OH)2.
+ Nếu kết tủa tan dần, thu được dung dịch có màu xanh đặc trưng → dung dịch glycerol.
+ Nếu không có hiện tượng xuất hiện → dung dịch ethanol.
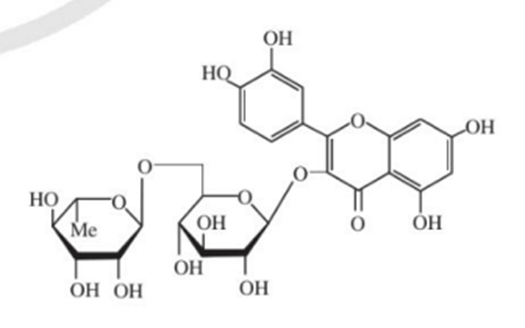
a) Phân tử rutin có bao nhiêu nhóm –OH alcohol và bao nhiêu nhóm –OH phenol?
b) Có hai phương pháp tách rutin từ hoa hoè như sau:
- Phương pháp 1: Hoa hoè xử lí bằng dung dịch sodium hydroxyde. Lọc, acid hoá phần nước lọc, thu được rutin.
- Phương pháp 2: Chiết rutin từ hoa hoè bằng nước nóng sau đó để nguội, rutin sẽ tách ra.
Em hãy cho biết mỗi phương pháp trên đã dựa vào tính chất nào của rutin.
Lời giải:
a) Phân tử rutin có 6 nhóm –OH alcohol và 4 nhóm –OH phenol.
b) Phương pháp 1 dựa vào tính chất hoá học của rutin, tác dụng được với sodium hydroxide.
Phương pháp 2 dựa vào tính chất hoá học của rutin, tan nhiều trong nước nóng.
Lý thuyết Phenol
I. Khái niệm
1. Khái niệm
- Phenol là những hợp chất hữu cơ trong phân tử có một hay nhiều nhóm hydroxy liên kết trực tiếp với nguyên tử carbon của vòng benzene.
- Phenol đơn giản nhất là C6H5-OH.
2. Phân loại
-Monophenol: những phenol trong phân tử chứa một nhóm –OH.
-Polyphenol: những phenol trong phân tử chứa nhiều nhóm –OH.
II. Tính chất vật lý
- Ở điều kiện thường, phenol là chất rắn, không màu.
- Tan ít trong nước lạnh, tan nhiều trong nước nóng, tan tốt trong các dung môi hữu cơ.
- Khi để lâu, phenol bị chuyển sang màu hồng do bị oxi hóa bởi oxygen trong không khí.
- Phenol rất độc, khi tiếp xúc với da phenol gây bỏng.
III. Tính chất hóa học
1. Tính acid của phenol
- Phenol thể hiện tính acid yếu, dung dịch phenol không làm đổi màu quỳ tím.
a) Phản ứng với dung dịch NaOH
C6H5OH + NaOH → C6H5ONa + H2O
b) Phản ứng với dung dịch sodium carbonate
![]()
2. Phản ứng thế nguyên tử H của vòng benzene
a) Phản ứng với nước bromie
b) Phản ứng với dung dịch HNO3 đặc
IV. Ứng dụng và điều chế
1. Ứng dụng
- Được sử dụng nhiều trong công nghiệp hóa chất: sản xuất nhựa epoxy, sản xuất phẩm nhuộm, thuốc nổ, chất diệt cỏ,…
- Phenol còn được sử dụng trong y học: làm chất khử trùng, tẩy uế, thuốc chữa đau họng.
2. Điều chế
- Trong công nghiệp phenol được sản xuất theo sơ đồ sau:
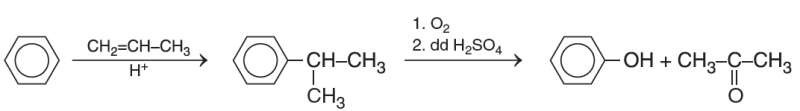
- Phenol cũng được tách ra từ nhựa than đá trong quá trình luyện cốc.
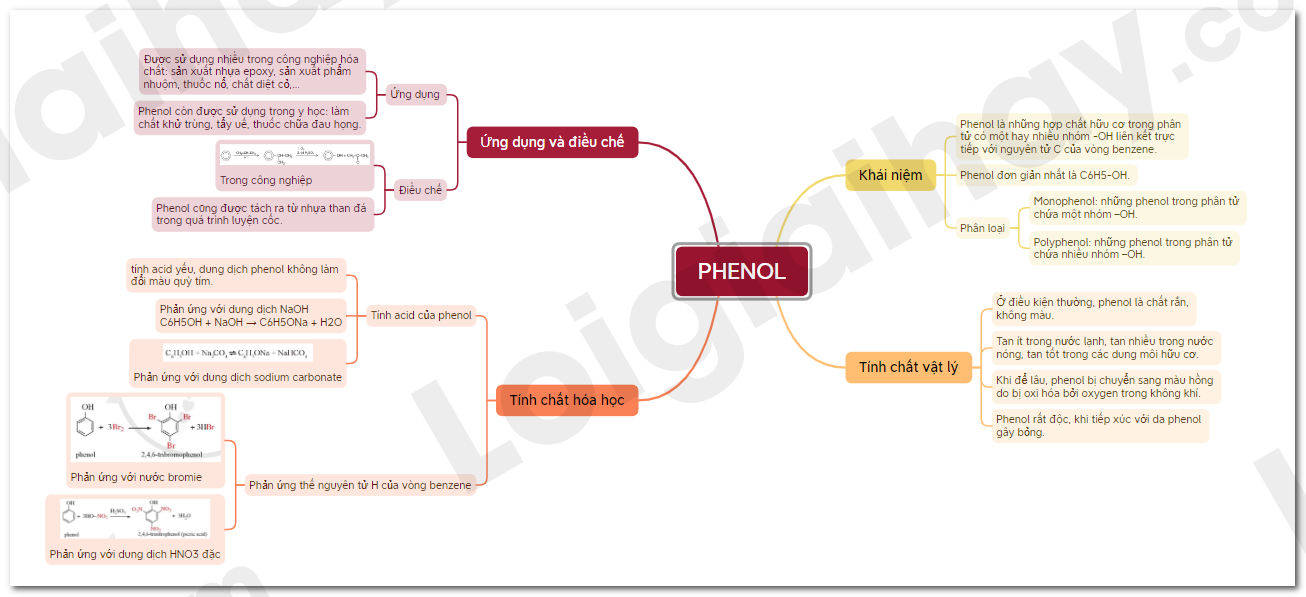
Sơ đồ tư duy Pheno
Xem thêm lời giải bài tập Hóa học lớp 11 Cánh diều hay, chi tiết khác:
Xem thêm các chương trình khác:
- Soạn văn lớp 11 Cánh diều (hay nhất)
- Văn mẫu lớp 11 - Cánh diều
- Tóm tắt tác phẩm Ngữ văn 11 – Cánh diều
- Tác giả tác phẩm Ngữ văn 11 - Cánh diều
- Giải SBT Ngữ văn 11 – Cánh diều
- Bố cục tác phẩm Ngữ văn 11 – Cánh diều
- Giải Chuyên đề học tập Ngữ văn 11 – Cánh diều
- Nội dung chính tác phẩm Ngữ văn lớp 11 – Cánh diều
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 – Cánh diều
- Giải Chuyên đề học tập Toán 11 – Cánh diều
- Lý thuyết Toán 11 - Cánh diều
- Giải sbt Toán 11 – Cánh diều
- Giải sgk Tiếng Anh 11 – ilearn Smart World
- Giải sbt Tiếng Anh 11 - ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh 11 ilearn Smart World đầy đủ nhất
- Giải sgk Vật lí 11 – Cánh diều
- Lý thuyết Vật lí 11 – Cánh diều
- Giải sbt Vật lí 11 – Cánh diều
- Giải Chuyên đề học tập Vật lí 11 – Cánh diều
- Giải sgk Sinh học 11 – Cánh diều
- Lý thuyết Sinh học 11 – Cánh diều
- Giải Chuyên đề học tập Sinh học 11 – Cánh diều
- Giải sbt Sinh học 11 – Cánh diều
- Giải sgk Giáo dục Kinh tế và Pháp luật 11 – Cánh diều
- Giải Chuyên đề học tập Kinh tế pháp luật 11 – Cánh diều
- Lý thuyết Kinh tế pháp luật 11 – Cánh diều
- Giải sbt Kinh tế pháp luật 11 – Cánh diều
- Giải sgk Lịch sử 11 – Cánh diều
- Giải Chuyên đề học tập Lịch sử 11 – Cánh diều
- Lý thuyết Lịch sử 11 - Cánh diều
- Giải sbt Lịch sử 11 – Cánh diều
- Giải sgk Địa lí 11 – Cánh diều
- Giải Chuyên đề học tập Địa lí 11 – Cánh diều
- Lý thuyết Địa lí 11 - Cánh diều
- Giải sbt Địa lí 11 – Cánh diều
- Giải sgk Công nghệ 11 – Cánh diều
- Lý thuyết Công nghệ 11 - Cánh diều
- Giải sbt Công nghệ 11 – Cánh diều
- Giải sgk Tin học 11 – Cánh diều
- Giải Chuyên đề học tập Tin học 11 – Cánh diều
- Lý thuyết Tin học 11 - Cánh diều
- Giải sbt Tin học 11 – Cánh diều
- Giải sgk Giáo dục quốc phòng an ninh 11 – Cánh diều
- Lý thuyết Giáo dục quốc phòng 11 – Cánh diều
- Giải sbt Giáo dục quốc phòng 11 – Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 – Cánh diều