Lý thuyết Hóa 10 Bài 29: Oxi – ozon
Tóm tắt lý thuyết Hóa 10 Bài 29: Oxi – ozon ngắn gọn, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm Hóa 10 Bài 29.
Lý thuyết Hóa 10 Bài 29: Oxi – ozon
I. Oxi
1. Vị trí và cấu tạo
- Nguyên tố oxi có số hiệu nguyên tử là 8, thuộc nhóm VIA, chu kì 2 của bảng tuần hoàn các nguyên tố hoá học.
- Nguyên tử oxi có cấu hình electron là 1s22s22p4, lớp ngoài cùng có 6e.
- Trong điều kiện bình thường, phân tử oxi có 2 nguyên tử liên kết với nhau bằng liên kết cộng hoá trị không cực.
- Công thức cấu tạo của phân tử oxi là O=O.
2. Tính chất vật lý
- Khí oxi không màu, không mùi, không vị, hơi nặng hơn không khí (d=3229≈1,1).
- Dưới áp suất khí quyển, oxi hoá lỏng ở nhiệt độ -1830C.
- Khí oxi tan ít trong nước (100ml nước ở 200C, 1 atm hoà tan được 3,1ml khí oxi. Độ tan của khí oxi ở 200C và 1 atm là 0,0043 g trong 100g H2O).
3. Tính chất hóa học
Khi tham gia phản ứng, nguyên tử O dễ dàng nhận thêm 2e. Nguyên tử oxi có độ âm điện lớn (3,44), chỉ kém flo (3,98).
Do vậy, oxi là nguyên tố phi kim hoạt động hoá học, có tính oxi hoá mạnh. Trong các hợp chất (trừ hợp chất với flo), nguyên tố oxi có số oxi hoá là -2.
Oxi tác dụng với hầu hết các kim loại (trừ Au, Pt ...) và các phi kim (trừ halogen). Oxi tác dụng với nhiều hợp chất vô cơ và hữu cơ. Cụ thể:
- Tác dụng với kim loại
Oxi tác dụng với hầu hết kim loại (trừ Au và Pt) , cần có to tạo ra oxit. Phương trình hóa học minh họa:
4Al + 3O2 to→ 2Al2O3
3Fe + 2O2 to→ Fe3O4

Hình 1: Đốt bột nhôm trong không khí
- Tác dụng với phi kim
Oxi tác dụng với hầu hết phi kim (trừ halogen), cần có to tạo oxit. Phương trình hóa học minh họa:
C + O2 to→CO2
S + O2 to→SO2

Hình 2: Lưu huỳnh cháy trong oxi
- Tác dụng với hợp chất
Phương trình hóa học minh họa:
2H2S + 3O2 to→ 2H2O + 2SO2
C2H5OH + 3O2 to→2CO2 + 3H2O
4. Ứng dụng
- Oxi có vai trò quyết định sự sống của con người và động vật. Mỗi người mỗi ngày cần 20-30m3 không khí để thở.
- Hằng năm các nước trên thế giới sản xuất hàng chục triệu tấn oxi để đáp ứng nhu cầu cho các ngành công nghiệp.
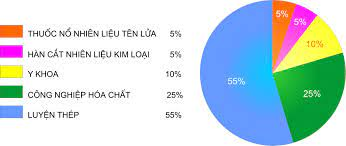
Hình 3: Biểu đồ những ứng dụng chính của oxi
5. Điều chế
- Trong phòng thí nghiệm:
Trong phòng thí nghiệm, khí oxi được điều chế bằng cách phân huỷ những hợp chất giàu oxi và ít bền đối với nhiệt như KMnO4 (rắn), KClO3 (rắn)...
Phương trình hóa học minh họa:
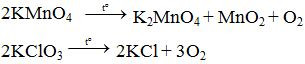
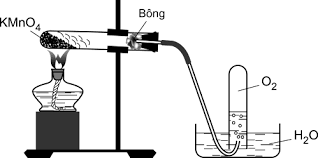
Hình 4: Điều chế oxi bằng cách phân hủy KMnO4
- Trong công nghiệp:
+ Từ không khí: Không khí sau khi đã loại bỏ hết hơi nước, bụi, khí cacbon đioxit, được hoá lỏng. Chưng cất phân đoạn không khí lỏng, thu được oxi. Oxi được vận chuyển trong những bình thép có dung tích 100 lít dưới áp suất 150 atm.
+ Từ nước: Điện phân nước (nước có hoà tan một ít H2SO4 hoặc NaOH để tăng tính dẫn điện của nước), người ta thu được khí oxi ở cực dương và khí hiđro ở cực âm.
II. Ozon
1. Tính chất vật lý
- Ozon là một dạng thù hình của khí oxi.
- Khí ozon màu xanh nhạt, có mùi đặc trưng, hóa lỏng ở -1120C, ozon lỏng có màu xanh đậm.
- Khí ozon tan trong nước nhiều hơn oxi.
2. Tính chất hóa học
- Ozon có tính oxi hóa rất mạnh và mạnh hơn oxi.
- Ozon oxi hóa được hầu hết các kim loại (trừ Au, Pt), nhiều phi kim và nhiều hợp chất vô cơ, hữu cơ. Cụ thể:
+ Ozon oxi hóa được ion I- thành I2:
O3 + 2KI + H2O → I2 + 2KOH + O2
+ Oxi hóa được Ag thành Ag2O ngay điều kiện thường:
2Ag + O3 → Ag2O + O2
3. Ứng dụng
- Lượng nhỏ ozon trong không khí có tác dụng làm cho không khí trong lành.
- Tẩy trắng các loại tinh bột, dầu ăn và nhiều chất khác.
- Khử trùng nước ăn, khử mùi, bảo quản hoa quả.
- Trong y học, ozon dùng để chữa sâu răng.
Xem thêm các bài tổng hợp lý thuyết Hóa học lớp 10 đầy đủ, chi tiết khác:
Lý thuyết Bài 32: Hiđro sunfua – lưu huỳnh đioxit – lưu huỳnh trioxit
Lý thuyết Bài 33: Axit sunfuric và muối sunfat
Xem thêm các chương trình khác:
- Giải sgk Vật Lí 10 | Giải bài tập Vật lí 10 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 10
- Tóm tắt tác phẩm Ngữ văn 10
- Soạn văn 10 (hay nhất) | Để học tốt Ngữ Văn 10 (sách mới)
- Soạn văn 10 (ngắn nhất) | Để học tốt Ngữ văn 10 (sách mới)
- Văn mẫu lớp 10 (cả ba sách) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Lịch sử 10 | Giải bài tập Lịch sử 10 Học kì 1, Học kì 2 (sách mới)
