Lý thuyết Hóa 10 Bài 22: Clo
Tóm tắt lý thuyết Hóa 10 Bài 22: Clo ngắn gọn, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm Hóa 10 Bài 22 để học tốt môn Hóa học lớp 10.
Lý thuyết Hóa 10 Bài 22: Clo
Bài giảng Hóa 10 Bài 22: Clo
I. Tính chất vật lí
- Ở điều kiện thường, clo là chất khí, màu vàng lục, mùi xốc, rất độc, nó phá hoại niêm mạc của đường hô hấp.

Hình 1: Khí clo
- Khí clo nặng gấp 2,5 lần không khí (d = ) và tan trong nước.
- Ở 20oC, một thể tích nước hòa tan được 2,5 thể tích khí clo. Dung dịch của khí clo trong nước gọi là nước clo có màu vàng nhạt.
- Khí clo tan nhiều trong các dung môi hữu cơ như benzen, etanol, hexan, cacbon tetraclorua…
II. Tính chất hóa học
- Nguyên tử clo có độ âm điện lớn (3,16) chỉ sau F (3,98) và O (3,44). Vì vậy trong các hợp chất với các nguyên tố này clo có số oxi hóa dương (+1; +3; +5; +7), còn trong các trường hợp khác clo có số oxi hóa âm (-1).
- Khi tham gia phản ứng hóa học clo dễ dàng nhận thêm 1 electron:
Cl + 1e → Cl-
⇒ Tính chất hóa học cơ bản của clo là tính oxi hóa mạnh.
1. Tác dụng với kim loại
- Khí clo oxi hóa trực tiếp được hầu hết các kim loại tạo thành muối clorua. Phản ứng xảy ra ở nhiệt độ thường hoặc không cao lắm, phản ứng xảy ra nhanh, tỏa nhiều nhiệt.
- Ví dụ:
2Na + Cl2 2NaCl
2Fe + 3Cl2 2FeCl3
Cu + Cl2 CuCl2
- Trong phản ứng với kim loại clo thể hiện tính oxi hóa.
Hình 2: Dây sắt cháy trong khí clo
2. Tác dụng với hiđro
- Ở nhiệt độ thường và trong bóng tối, khí clo hầu như không phản ứng với khí hiđro.
- Khi chiếu sáng hỗn hợp bởi ánh sáng mặt trời hoặc ánh sáng của magie cháy, phản ứng xảy ra và có thể nổ. Hỗn hợp nổ mạnh nhất khi tỉ lệ số mol giữa hiđro và clo là 1 : 1.
- Phương trình hóa học:
H2 + Cl2 2HCl
- Trong phản ứng với H2, clo thể hiện tính oxi hóa.
Hình 3: Clo tác dụng với hiđro
3. Tác dụng với nước
- Khi tan trong nước, một phần khí clo tác dụng với nước tạo ra hỗn hợp axit clohiđric và axit hipoclozơ.
- Phương trình hóa học:
Trong phản ứng trên clo vừa là chất oxi hóa vừa là chất khử.
- Phản ứng trên là phản ứng thuận nghịch do HClO là chất oxi hóa mạnh, có thể oxi hóa HCl thành Cl2 và H2O. Cũng do HClO có tính oxi hóa mạnh nên nước clo có tính tẩy màu.
- Chú ý: Thành phần của nước clo gồm: Cl2; HCl; HClO; H2O
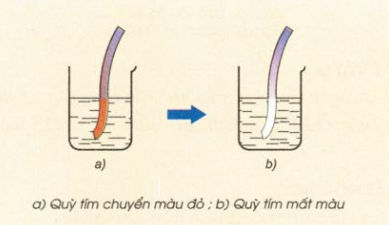
Hình 4: Nhúng giấy quỳ tím vào nước clo
Mở rộng:
Ngoài ra, clo có thể tham gia một số phản ứng hóa học khác như:
- Tác dụng với dung dịch bazơ:
Cl2 + 2NaOH → NaCl + NaClO + H2O
3Cl2 + 6KOH KClO3 + 5KCl + 3H2O
- Tác dụng với muối của các halogen khác
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2FeCl2 → 2FeCl3
- Tác dụng với chất khử khác
3Cl2 + 2NH3 N2 + 6HCl
Cl2 + SO2 + 2H2O H2SO4 + 2HCl
III. Trạng thái tự nhiên
- Trong tự nhiên Clo có 2 đồng vị bền là 35Cl (75,77%) và 37Cl (24,23%) ⇒ Nguyên tử khối trung bình của clo là 35,5.
- Do hoạt động hóa học mạnh nên clo chỉ tồn tại trong tự nhiên ở dạng hợp chất, chủ yếu là muối clorua có trong nước biển và muối mỏ. Trong nước biển clo chiếm khoảng 2% khối lượng.
- Hợp chất khác của clo cũng phổ biến trong tự nhiên như cacnalit KCl.MgCl2.6H2O. Axit clohiđric cũng có trong dịch vị của người và động vật.
IV. Ứng dụng
Một số ứng dụng quan trọng của clo:
- Dùng để diệt trùng nước sinh hoạt.
- Tẩy trắng sợi, giấy, vải.
- Là nguyên liệu để sản xuất nhiều hợp chất vô cơ và hữu cơ (như nước gia – ven; clorua vôi; dung môi điclo etan…). Sản phẩm hữu cơ chứa clo có ý nghĩa to lớn trong công nghiệp.
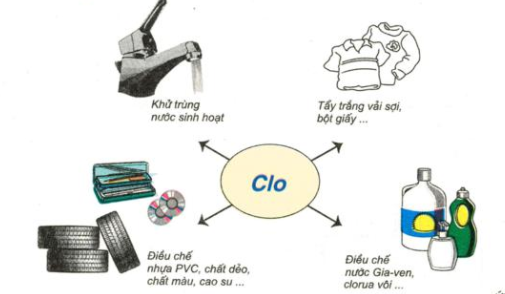
Hình 5: Sơ đồ về một số ứng dụng của khí clo
V. Điều chế
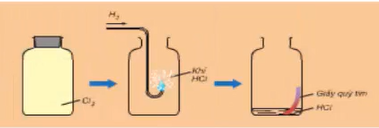
1. Trong phòng thí nghiệm
- Phương pháp: Đun nóng nhẹ dung dịch HCl đậm đặc với các chất oxi hóa mạnh như MnO2, KMnO4,...
- Ví dụ:
MnO2 + 4HCl MnCl2 + Cl2 + 2H2O
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 ↑ + 8H2O
- Thu khí clo bằng cách đẩy không khí.
Hình 6: Điều chế clo trong phòng thí nghiệm
2. Trong công nghiệp
- Phương pháp: Điện phân dung dịch NaCl bão hòa (có màng ngăn xốp ngăn không cho khí Cl2 thoát ra tác dụng với NaOH tạo thành nước Gia-ven)
- Phương trình hóa học minh họa:
2NaCl + 2H2O 2NaOH + Cl2 + H2
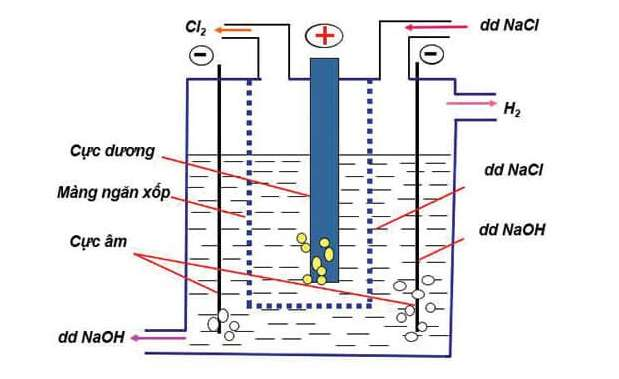
Hình 7: Sơ đồ thùng điện phân dung dịch NaCl
Xem thêm các bài tổng hợp lý thuyết Hóa học lớp 10 đầy đủ, chi tiết khác:
Lý thuyết Bài 23: Hiđro clorua – Axit clohiđric và muối clorua
Lý thuyết Bài 24: Sơ lược về hợp chất có oxi của clo
Lý thuyết Bài 25: Flo – brom – iot
Xem thêm các chương trình khác:
- Giải sgk Vật Lí 10 | Giải bài tập Vật lí 10 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 10
- Tóm tắt tác phẩm Ngữ văn 10
- Soạn văn 10 (hay nhất) | Để học tốt Ngữ Văn 10 (sách mới)
- Soạn văn 10 (ngắn nhất) | Để học tốt Ngữ văn 10 (sách mới)
- Văn mẫu lớp 10 (cả ba sách) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Lịch sử 10 | Giải bài tập Lịch sử 10 Học kì 1, Học kì 2 (sách mới)
