Lý thuyết Hóa 10 Bài 33: Axit sunfuric và muối sunfat
Tóm tắt lý thuyết Hóa 10 Bài 33: Axit sunfuric và muối sunfat ngắn gọn, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm Hóa 10 Bài 33.
Lý thuyết Hóa 10 Bài 33: Axit sunfuric và muối sunfat
I. Axit sunfuric
1. Tính chất vật lí
- Axit sunfuric (H2SO4) là chất lỏng sánh như dầu, không màu, không bay hơi, nặng gần gấp 2 lần nước (H2SO4 98% có D = 1,84 g/cm3).
- H2SO4 tan vô hạn trong nước và toả nhiệt rất nhiều nhiệt. Nếu ta rót nước vào H2SO4, nước sôi đột ngột và kéo theo những giọt axit bắn ra xung quanh gây nguy hiểm.
- Cách pha loãng axit sunfuric đặc an toàn: Rót từ từ axit vào nước và khuấy nhẹ bằng đũa thuỷ tinh mà không được làm ngược lại.
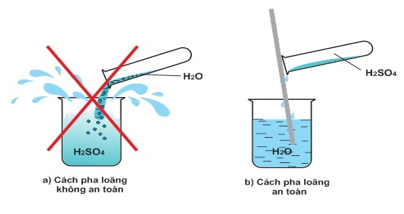
Hình 1: Cách pha loãng H2SO4 đặc
2. Tính chất hóa học
a. Tính chất của dung dịch axit sunfuric loãng
H2SO4 loãng có đầy đủ tính chất của một axit mạnh.
- Làm đổi màu quỳ tím thành đỏ
- Tác dụng với nhiều kim loại (Mg, Al, Zn, Fe,...) tạo thành muối sunfat và giải phóng khí hiđro.
Ví dụ:
H2SO4 (loãng) + Mg → MgSO4 + H2 (↑)
3H2SO4 (loãng) + 2Al → Al2(SO4)3 + 3H2 (↑)
Chú ý: Các kim loại Hg, Cu, Ag, Au, Pt …không tác dụng với H2SO4 loãng.
Khi Fe tác dụng với H2SO4 loãng, sản phẩm thu được là muối sắt (II)
H2SO4 (loãng) + Fe → FeSO4 + H2 (↑)
- Tác dụng với bazơ tạo thành muối sunfat và nước.
Ví dụ:
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
H2SO4 + 2KOH → K2SO4 + 2H2O
- Tác dụng với oxit bazơ tạo thành muối sunfat và nước.
Ví dụ:
H2SO4 + CuO → CuSO4 + H2O
H2SO4 + Na2O → Na2SO4 + H2O
- Tác dụng với một số muối tạo thành muối sunfat và axit mới
Ví dụ:
MgCO3 + H2SO4 → MgSO4 + CO2 ↑ + H2O
b. Tính chất của axit sunfuric đặc
- Tính oxi hóa mạnh
+ Axit sunfuric đặc oxi hoá hầu hết các kim loại (trừ Au và Pt) tạo muối hoá trị cao và thường giải phóng SO2 (có thể H2S, S nếu kim loại khử mạnh như Mg).
2Fe + 6H2SO4 Fe2(SO4)3 + 3SO2 + 6H2O
Cu + 2H2SO4 CuSO4 + SO2 + 2H2O

Hình 2: Phản ứng của Cu với H2SO4
Chú ý: Al, Fe, Cr bị thụ động hóa trong H2SO4 đặc, nguội.
+ Tác dụng với nhiều phi kim:
C + 2H2SO4 CO2 + 2SO2 + 2H2O
S + 2H2SO4 3SO2 + 2H2O
+ Tác dụng với nhiều hợp chất có tính khử:
2FeO + 4H2SO4 Fe2(SO4)3 + SO2 + 4H2O
2KBr + 2H2SO4 Br2 + SO2 + 2H2O + K2SO4
Ngoài ra H2SO4 đặc có tính háo nước:
Axit sunfuric đặc chiếm nước kết tinh của nhiều muối ngậm nước, hoặc chiếm các nguyên tố H và O (thành phần của nước) trong nhiều hợp chất.
Ví dụ:
Khi cho axit H2SO4 đặc vào đường, đường sẽ hóa thành than.
C12H22O11 12C + 11H2O
Sau đó một phần C sinh ra lại bị H2SO4 đặc oxi hóa:
C + 2H2SO4 (đặc) → CO2 + 2SO2 + 2H2O

Hình 3: H2SO4 đặc tác dụng với đường.
3. Ứng dụng
- Axit sunfuric là hoá chất hàng đầu được dùng trong nhiều ngành sản xuất. Hàng năm, các nước trên thế giới sản xuất khoảng 160 triệu tấn H2SO4.
- Axit sunfuric được dùng để sản xuất phân bón, thuốc trừ sâu, chất giặt rửa tổng hợp, tơ sợi hoá học, chất dẻo, sơn màu, phẩm nhuộm, dược phẩm, chế biến dầu mỏ...
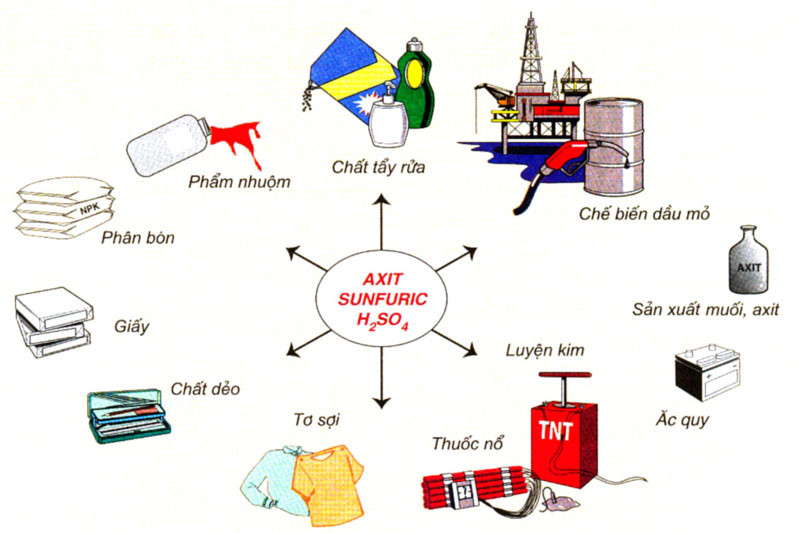
Hình 4: Sơ đồ về một số ứng dụng của axit sunfuric
4. Sản xuất
Axit sunfuric được sản xuất trong công nghiệp bằng phương pháp tiếp xúc. Phương pháp này có 3 công đoạn chính:
- Sản xuất lưu huỳnh đioxit (SO2)
Phụ thuộc vào nguồn nguyên liệu có sẵn, người ta đi từ nguyên liệu ban đầu là lưu huỳnh hoặc pirit sắt FeS2...
+ Đốt cháy lưu huỳnh: S + O2 SO2
+ Đốt quặng pirit sắt FeS2: 4FeS2 + 11O2 2Fe2O3 + 8SO2
- Sản xuất lưu huỳnh trioxit (SO3)
Oxi hoá SO2 bằng khí oxi hoặc không khí dư ở nhiệt độ 450 - 5000C, xúc tác V2O5:
2SO2 + O2 2SO3
- Hấp thụ SO3 bằng H2SO4
Dùng H2SO4 98% hấp thụ SO3, được oleum H2SO4 .nSO3:
H2SO4 + nSO3 → H2SO4 .nSO3
Sau đó dùng lượng nước thích hợp pha loãng oleum, được H2SO4 đặc:
H2SO4 .nSO3 + nH2O → (n + 1) H2SO4
II. Muối sunfat và nhận biết ion sunfat
1. Muối sunfat
Muối sunfat là muối của axit sunfuric. Có 2 loại muối sunfat:
- Muối trung hoà (muối sunfat) chứa ion sunfat SO42-. Phần lớn muối sunfat đều tan trừ BaSO4, SrSO4, PbSO4 không tan.
- Muối axit (muối hiđrosunfat) chứa ion hiđrosunfat HSO4-
2. Nhận biết ion sunfat
Thuốc thử nhận biết ion sunfat là dung dịch muối bari hoặc dung dịch Ba(OH)2. Sản phẩm phản ứng là bari sunfat BaSO4 kết tủa trắng, không tan trong axit.
H2SO4 + BaCl2 → BaSO4 ↓ + 2HCl
Na2SO4 + Ba(OH)2 →BaSO4↓ + 2NaOH

Hình 5: Kết tủa trắng BaSO4
Xem thêm các bài tổng hợp lý thuyết Hóa học lớp 10 đầy đủ, chi tiết khác:
Lý thuyết Bài 32: Hiđro sunfua – lưu huỳnh đioxit – lưu huỳnh trioxit
Lý thuyết Bài 34: Luyện tập: Oxi – lưu huỳnh
Lý thuyết Bài 36: Tốc độ phản ứng hóa học
Lý thuyết Bài 38: Cân bằng hóa học
Lý thuyết Bài 39: Luyện tập tốc độ phản ứng và cân bằng hóa học
Xem thêm các chương trình khác:
- Giải sgk Vật Lí 10 | Giải bài tập Vật lí 10 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 10
- Tóm tắt tác phẩm Ngữ văn 10
- Soạn văn 10 (hay nhất) | Để học tốt Ngữ Văn 10 (sách mới)
- Soạn văn 10 (ngắn nhất) | Để học tốt Ngữ văn 10 (sách mới)
- Văn mẫu lớp 10 (cả ba sách) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Lịch sử 10 | Giải bài tập Lịch sử 10 Học kì 1, Học kì 2 (sách mới)
