Lý thuyết Hóa 10 Bài 39: Luyện tập tốc độ phản ứng và cân bằng hóa học
Tóm tắt lý thuyết Hóa 10 Bài 39: Luyện tập tốc độ phản ứng và cân bằng hóa học ngắn gọn, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm Hóa 10 Bài 39.
Lý thuyết Hóa 10 Bài 39: Luyện tập tốc độ phản ứng và cân bằng hóa học
Kiến thức cần nắm vững:
1. Tốc độ phản ứng
- Tốc độ phản ứng là độ biến thiên nồng độ của một chất trong các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian.
- Các yếu tố ảnh hưởng đến tốc độ phản ứng:
+ Nồng độ: Tăng nồng độ chất phản ứng → tốc độ phản ứng tăng (trừ một số ngoại lệ).
+ Áp suất: Đối với phản ứng có chất khí, tăng áp suất → tốc độ phản ứng tăng.
+ Nhiệt độ: Tăng nhiệt độ → tốc độ phản ứng tăng (trừ một số ngoại lệ).
+ Diện tích tiếp xúc: Tăng diện tích tiếp xúc của chất phản ứng → tốc độ phản ứng tăng
+ Chất xúc tác: Tùy từng phản ứng, chất xúc tác giúp tăng tốc độ phản ứng.
2. Cân bằng hóa học
- Cân bằng hóa học là trạng thái của phản ứng thuận nghịch khi tốc độ phản ứng thuận và tốc độ phản ứng nghịch bằng nhau.
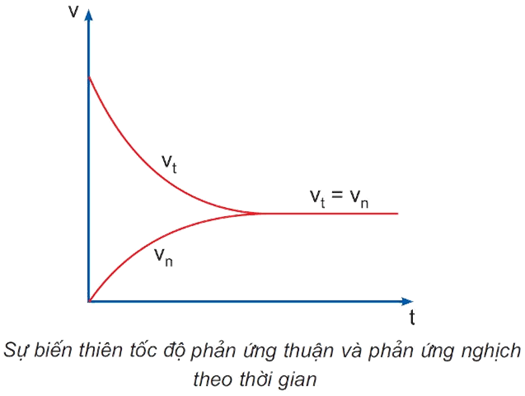
3. Sự chuyển dịch cân bằng
- Nguyên lí Lơ Sa-tơ-li-ê: Một phản ứng thuận nghịch đang ở trạng thái cân bằng, khi chịu một tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.
- Các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học:
+ Khi tăng nồng độ một chất (trừ chất rắn) trong cân bằng thì cân bằng chuyển dịch theo chiều phản ứng làm giảm nồng độ chất đó và ngược lại.
+ Khi tăng áp suất chung của hệ thì cân bằng chuyển dịch theo chiều phản ứng có số mol khí ít hơn và ngược lại. Nếu hệ phản ứng có số phân tử khí ở phản ứng thuận bằng số phân tử khí ở phản ứng nghịch thì sự thay đổi áp suất không làm chuyển dịch cân bằng.
+ Khi tăng nhiệt độ thì cân bằng sẽ chuyển dịch theo chiều của phản ứng thu nhiệt và ngược lại.
Lưu ý: Chất xúc tác không có tác dụng làm chuyển dịch cân bằng.
Xem thêm các bài tổng hợp lý thuyết Hóa học lớp 10 đầy đủ, chi tiết khác:
Lý thuyết Bài 32: Hiđro sunfua – lưu huỳnh đioxit – lưu huỳnh trioxit
Lý thuyết Bài 33: Axit sunfuric và muối sunfat
Lý thuyết Bài 34: Luyện tập: Oxi – lưu huỳnh
Xem thêm các chương trình khác:
- Giải sgk Vật Lí 10 | Giải bài tập Vật lí 10 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 10
- Tóm tắt tác phẩm Ngữ văn 10
- Soạn văn 10 (hay nhất) | Để học tốt Ngữ Văn 10 (sách mới)
- Soạn văn 10 (ngắn nhất) | Để học tốt Ngữ văn 10 (sách mới)
- Văn mẫu lớp 10 (cả ba sách) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Lịch sử 10 | Giải bài tập Lịch sử 10 Học kì 1, Học kì 2 (sách mới)
