Lý thuyết Hóa 10 Bài 32: Hiđro sunfua – lưu huỳnh đioxit – lưu huỳnh trioxit
Tóm tắt lý thuyết Hóa 10 Bài 32: Hiđro sunfua – lưu huỳnh đioxit – lưu huỳnh trioxit ngắn gọn, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm Hóa 10 Bài 32.
Lý thuyết Hóa 10 Bài 32: Hiđro sunfua – lưu huỳnh đioxit – lưu huỳnh trioxit
A. Hiđro sunfua
I. Tính chất vật lí
- Hiđro sunfua là chất khí, rất độc, không màu, mùi trứng thối, hơi nặng hơn không khí ().
- Hiđro sunfua hóa lỏng ở -600C, tan ít trong nước, độ tan trong nước S = 0,38g/100g H2O (ở 200C, 1atm)
II. Tính chất hóa học
1. Tính axit yếu
- Hiđro sunfua tan trong nước tạo thành dung dịch axit rất yếu (yếu hơn axit cacbonic), có tên là axit sunfuhiđric (H2S).
- Axit sunfuhiđric tác dụng với kiềm tạo nên 2 loại muối: muối trung hòa, như Na2S chứa ion S2− và muối axit như NaHS chứa ion HS−. Phương trình hóa học minh họa:
H2S + NaOH → NaHS + H2O
H2S + 2NaOH → Na2S + 2H2O
2. Tính khử mạnh
- H2S là chất khử mạnh vì trong H2S lưu huỳnh có số oxi hoá thấp nhất (-2).
- Khi tham gia phản ứng hóa học, tùy thuộc vào điều kiện phản ứng mà có thể bị oxi hóa thành
- H2S tác dụng với oxi có thể tạo S hoặc SO2 tùy lượng oxi và cách tiến hành phản ứng.
2H2S + 3O2 dư 2H2O + 2SO2
2H2S + O2 thiếu 2H2O + 2S
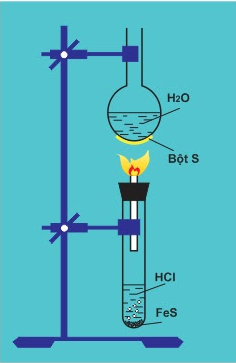
Đốt H2S trong điều kiện thiếu oxi
- Ở nhiệt độ cao, khí H2S cháy trong không khí với ngọn lửa xanh nhạt, H2S bị oxi hóa thành SO2:
2H2S + 3O2 2H2O + 2SO2
IV. Trạng thái tự nhiên. Điều chế
- Trong tự nhiên, H2S có trong một số nước muối, khí núi lửa và bốc ra từ xác chết của người và động vật …
- Trong công nghiệp không sản xuất H2S.
- Trong phòng thí nghiệm điều chế bằng cách cho dd HCl tác dụng với sắt(II) sunfua:
FeS + 2HCl → FeCl2 + H2S
B. Lưu huỳnh đioxit (khí sunfurơ)
I. Tính chất vật lí
- Là không màu, mùi hắc, nặng hơn không khí (d = )
- Tan nhiều trong nước (ở 20oC, một thể tích nước có thể hòa tan được 40 thể tích SO2).
- Hóa lỏng ở -100C.
- Là khí độc, hít thở phải không khí có khí này sẽ gây viêm đường hô hấp.
II. Tính chất hóa học
1. Lưu huỳnh đioxit là oxit axit
- SO2 tan trong nước tạo thành axit yếu và không bền:
SO2 + H2O ⇆ H2SO3
- SO2 tác dụng với dd bazơ tạo nên 2 loại muối: muối axit HSO3-, muối trung hòa SO32-.
SO2 + NaOH → NaHSO3 (1)
SO2 + 2NaOH → Na2SO3 + H2O (2)
+ Nếu : chỉ xảy ra phản ứng (1)
+ Nếu 1 < < 2: xảy ra cả phản ứng (1) và (2)
+ Nếu : chỉ xảy ra phản ứng (2)
2. Lưu huỳnh đioxit là chất khử và là chất oxi hóa
a) SO2 là chất khử
Khi gặp chất oxi hóa mạnh như O2 , Cl2 , Br2 : khí SO2 đóng vai trò là chất khử:
SO2 + Br2 + 2H2O → 2HBr + H2SO4
5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
b) SO2 là chất oxi hoá khi tác dụng chất khử mạnh:
SO2 + 2H2S → 2H2O + 3S
III. Ứng dụng và điều chế lưu huỳnh đioxit
1. Ứng dụng
- Sản xuất axit sunfuric trong công nghiệp
- Tấy trắng giấy, bột giấy.
- Chống nấm mốc cho lương thực, thực phẩm …
2. Điều chế
- Trong phòng thí nghiệm: Đun nóng dd H2SO4 với muối Na2SO3, sau đó thu SO2 bằng cách đẩy không khí. Phương trình hóa học:
Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2
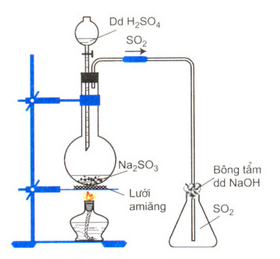
Điều chế SO2 trong PTN
- Trong công nghiệp
Đốt cháy S hoặc đốt cháy quặng pirit sắt:
4FeS2 + 11O2 2Fe2O3 + 8SO2
C. Lưu huỳnh trioxit
I. Tính chất
- Ở điều kiện thường, SO3 là chất lỏng không màu, tan vô hạn trong nước và trong axit H2SO4, tnc=170C, tsôi = 450C.
- Lưu huỳnh trioxit là một oxit axit:
+ Tác dụng với H2O tạo axit sunfuric: SO3 + H2O → H2SO4
+ Tác dụng với bazơ, oxit bazơ tạo muối sunfat:
SO3 + 2NaOH → Na2SO4 + H2O
SO3 + Na2O → Na2SO4
II. Ứng dụng và sản xuất
- Trong thực tiễn, SO3 có ít ứng dụng nhưng nó là sản phẩm trung gian để sản xuất axit H2SO4.
- Trong công nghiệp, người ta sản xuất SO3 bằng cách oxi hóa SO2 ở nhiệt độ cao 4500 – 500oC, xúc tác V2O5
2SO2 + O2 2SO3
Xem thêm các bài tổng hợp lý thuyết Hóa học lớp 10 đầy đủ, chi tiết khác:
Lý thuyết Bài 33: Axit sunfuric và muối sunfat
Lý thuyết Bài 34: Luyện tập: Oxi – lưu huỳnh
Lý thuyết Bài 36: Tốc độ phản ứng hóa học
Lý thuyết Bài 38: Cân bằng hóa học
Lý thuyết Bài 39: Luyện tập tốc độ phản ứng và cân bằng hóa học
Xem thêm các chương trình khác:
- Giải sgk Vật Lí 10 | Giải bài tập Vật lí 10 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 10
- Tóm tắt tác phẩm Ngữ văn 10
- Soạn văn 10 (hay nhất) | Để học tốt Ngữ Văn 10 (sách mới)
- Soạn văn 10 (ngắn nhất) | Để học tốt Ngữ văn 10 (sách mới)
- Văn mẫu lớp 10 (cả ba sách) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Lịch sử 10 | Giải bài tập Lịch sử 10 Học kì 1, Học kì 2 (sách mới)
