Lý thuyết Hóa 10 Bài 19: Luyện tập: Phản ứng oxi hóa – khử
Tóm tắt lý thuyết Hóa 10 Bài 19: Luyện tập: Phản ứng oxi hóa – khử ngắn gọn, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm Hóa 10 Bài 19.
Lý thuyết Hóa 10 Bài 19: Luyện tập: Phản ứng oxi hóa – khử
Bài giảng Hóa 10 Bài 19: Luyện tập: Phản ứng oxi hóa – khử
Kiến thức cần nắm vững
1. Sự oxi hóa là sự nhường electron, là sự tăng số oxi hóa.
Sự khử là sự thu electron là sự giảm số oxi hóa.
Người ta còn gọi sự oxi hóa là quá trình oxi hóa, sự khử là quá trình khử.
2. Sự oxi hóa và sự khử là hai quá trình có bản chất trái ngược nhau nhưng xảy ra đồng thời trong một phản ứng. Đó là phản ứng oxi hóa – khử.
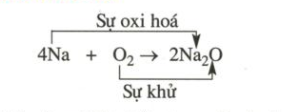
3. Chất khử là chất nhường electron, là chất chứa nguyên tố có số oxi hóa tăng sau phản ứng. Chất oxi hóa là chất thu electron, là chất chứa nguyên tố có số oxi hóa giảm sau phản ứng. Trong phản ứng oxi hóa – khử bao giờ cũng có chất khử và chất oxi hóa tham gia. Chất khử còn gọi là chất bị oxi hóa và chất oxi hóa còn gọi là chất bị khử.
Ví dụ:
+ Số oxi hóa của Fe tăng từ 0 lên + 2 ⇒ Fe là chất khử.
+ Số oxi hóa của H giảm từ +1 xuống 0 ⇒ HCl là chất oxi hóa.
4. Phản ứng oxi hóa – khử là phản ứng trong đó có sự chuyển electron giữa các chất phản ứng. Nếu dựa vào sự thay đổi số oxi hóa thì phản ứng oxi hóa – khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa của một số nguyên tố.
Ví dụ:
5. Dựa vào số oxi hóa người ta chia các phản ứng hóa học thành 2 loại, đó là phản ứng oxi hóa – khử (số oxi hóa thay đổi) và phản ứng không thuộc loại phản ứng oxi hóa khử (số oxi hóa không thay đổi).
Ví dụ:
+ Phản ứng có sự thay đổi số oxi hóa:
+ Phản ứng không có sự thay đổi số oxi hóa:
Xem thêm các bài tổng hợp lý thuyết Hóa học lớp 10 đầy đủ, chi tiết khác:
Lý thuyết Bài 21: Khái quát về nhóm halogen
Lý thuyết Bài 23: Hiđro clorua – Axit clohiđric và muối clorua
Xem thêm các chương trình khác:
- Giải sgk Vật Lí 10 | Giải bài tập Vật lí 10 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 10
- Tóm tắt tác phẩm Ngữ văn 10
- Soạn văn 10 (hay nhất) | Để học tốt Ngữ Văn 10 (sách mới)
- Soạn văn 10 (ngắn nhất) | Để học tốt Ngữ văn 10 (sách mới)
- Văn mẫu lớp 10 (cả ba sách) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Lịch sử 10 | Giải bài tập Lịch sử 10 Học kì 1, Học kì 2 (sách mới)
