Lý thuyết Hóa 10 Bài 30: Lưu huỳnh
Tóm tắt lý thuyết Hóa 10 Bài 30: Lưu huỳnh ngắn gọn, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm Hóa 10 Bài 30.
Lý thuyết Hóa 10 Bài 30: Lưu huỳnh
I. Vị trí, cấu hình electron nguyên tử
- Nguyên tử lưu huỳnh có số hiệu nguyên tử là 16, thuộc nhóm VIA, chu kì 3 của bảng tuần hoàn các nguyên tố hóa học.
- Nguyên tử lưu huỳnh có cấu hình electron: 1s22s22p63s23p4. Lớp ngoài cùng có 6 electron.

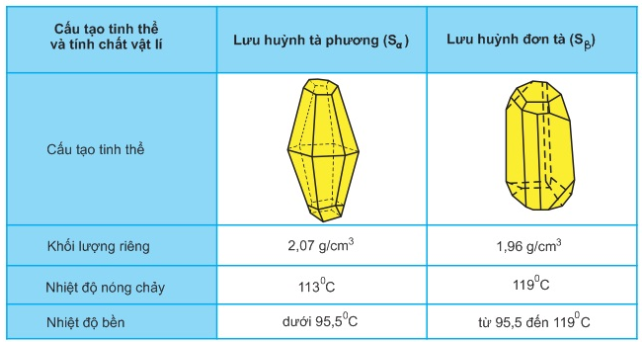
II. Tính chất vật lí
- Lưu huỳnh có 2 dạng thù hình: lưu huỳnh tà phương (Sα) và lưu huỳnh đơn tà (Sβ).
- Chúng khác nhau về cấu tạo tinh thể và 1 số tính chất vật lí nhưng có tính chất hóa học giống nhau. Hai dạng thù hình có thể biến đổi qua lại với nhau tùy theo điều kiện nhiệt độ.
III. Tính chất hóa học của lưu huỳnh
Lưu huỳnh trong hợp chất có các số oxi hóa -2; +4; +6. Như vậy khi tham gia phản ứng hóa học số oxi hóa của lưu huỳnh có thể tăng hoặc có thể giảm. Ta nói, lưu huỳnh có tính oxi hóa và tính khử.
1. Tác dụng với kim loại và hiđro
S thể hiện tính oxi hóa khi tác dụng với kim loại và hidro.
- Tác dụng với hiđro tạo thành khí hiđrosunfua:
H2 + S H2S
- Tác dụng với kim loại tạo thành muối sunfua:
Fe + S FeS
Zn + S ZnS

Bột sắt tác dụng với bột lưu huỳnh
Chú ý: Lưu huỳnh có thể phản ứng với thủy ngân ngay điều kiện thường:
Hg + S → HgS
2. Tác dụng với phi kim và hợp chất
S thể hiện tính khử khi tác dụng với 1 số phi kim và 1 số hợp chất có tính oxi hóa
- Tác dụng với phi kim:
S + O2 SO2
S + 3F2 SF6

Lưu huỳnh cháy trong oxi
- Tác dụng với các chất có tính oxi hóa mạnh
S + 2H2SO4 đặc 3SO2 + 2H2O
S + 4HNO3 đặc 2H2O + 4NO2 + SO2
III. Ứng dụng
Lưu huỳnh là nguyên liệu quan trọng cho nhiều ngành công nghiệp:
- 90% lượng lưu huỳnh khai thác dùng để sản xuất H2SO4.
- 10% lượng lưu huỳnh còn lại dùng để lưu hóa cao su, chế tạo diêm, sản xuất chất tẩy trắng bột giấy, chất dẻo ebonit, dược phẩm, phẩm nhuộm, chất trừ sâu, diệt nấm ...
IV. Trạng thái tự nhiên, sản xuất lưu huỳnh
1. Trạng thái tự nhiên
- Trong tự nhiên lưu huỳnh có nhiều ở dạng đơn chất, tạo thành những mỏ lớn trong vỏ Trái Đất.

Mỏ lưu huỳnh lộ thiên
- Ngoài ra lưu huỳnh còn có ở dạng hợp chất như các muối sunfat, sunfua …
2. Khai thác lưu huỳnh
- Để khai thác lưu huỳnh trong mỏ lưu huỳnh dưới lòng đất, người ta dùng thiết bị đặc biệt để nén nước siêu nóng (170oC) vào mỏ lưu huỳnh làm lưu huỳnh nóng chảy và đẩy lên mặt đất.
- Sau đó lưu huỳnh được tách ra khỏi các tạp chất.
Xem thêm các bài tổng hợp lý thuyết Hóa học lớp 10 đầy đủ, chi tiết khác:
Lý thuyết Bài 32: Hiđro sunfua – lưu huỳnh đioxit – lưu huỳnh trioxit
Lý thuyết Bài 33: Axit sunfuric và muối sunfat
Lý thuyết Bài 34: Luyện tập: Oxi – lưu huỳnh
Xem thêm các chương trình khác:
- Giải sgk Vật Lí 10 | Giải bài tập Vật lí 10 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 10
- Tóm tắt tác phẩm Ngữ văn 10
- Soạn văn 10 (hay nhất) | Để học tốt Ngữ Văn 10 (sách mới)
- Soạn văn 10 (ngắn nhất) | Để học tốt Ngữ văn 10 (sách mới)
- Văn mẫu lớp 10 (cả ba sách) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Lịch sử 10 | Giải bài tập Lịch sử 10 Học kì 1, Học kì 2 (sách mới)
