Lý thuyết Hóa 10 Bài 21: Khái quát về nhóm halogen
Tóm tắt lý thuyết Hóa 10 Bài 21: Khái quát về nhóm halogen ngắn gọn, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm Hóa 10 Bài 21.
Lý thuyết Hóa 10 Bài 21: Khái quát về nhóm halogen
Bài giảng Hóa 10 Bài 21: Khái quát về nhóm halogen
I. Vị trí nhóm halogen trong bảng tuần hoàn

- Nhóm halogen gồm các nguyên tố flo (F); clo (Cl); brom (Br), iot (I) và atatin (At). Atatin không gặp trong tự nhiên, nó được điều chế nhân tạo trong các lò phản ứng hạt nhân nên được xem xét chủ yếu ở nhóm các nguyên tố phóng xạ.
- Những nguyên tố nhóm halogen thuộc nhóm VIIA, chúng đứng ở cuối chu kì, ngay trước các nguyên tố khí hiếm.
II. Cấu hình electron nguyên tử và cấu tạo phân tử
- Lớp electron ngoài cùng của nguyên tử các nguyên tố halogen đều có 7 electron được phân thành hai phân lớp: phân lớp s có 2 electron; phân lớp p có 5 electron.
⇒ Cấu hình electron lớp ngoài cùng của nguyên tử các halogen là: ns2np5.
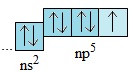
- Do có 7 electron ở lớp ngoài cùng, nên ở trạng thái tự do hai nguyên tử halogen ghép chung 1 đôi electron để tạo thành phân tử có liên kết cộng hóa trị không cực:
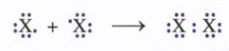
Hay X – X hay X2 (X là kí hiệu chỉ các nguyên tố halogen).
- Liên kết của phân tử X2 không bền lắm, chúng dễ tách thành 2 nguyên tử X. Trong các phản ứng hóa học, các nguyên tử này rất hoạt động vì chúng dễ nhận thêm một electron để đạt cấu hình bền vững của khí hiếm.
X + 1e → X- (X : F , Cl , Br , I)
⇒ Tính chất hóa học cơ bản của các halogen là tính oxi hóa mạnh.
III. Sự biến đổi tính chất
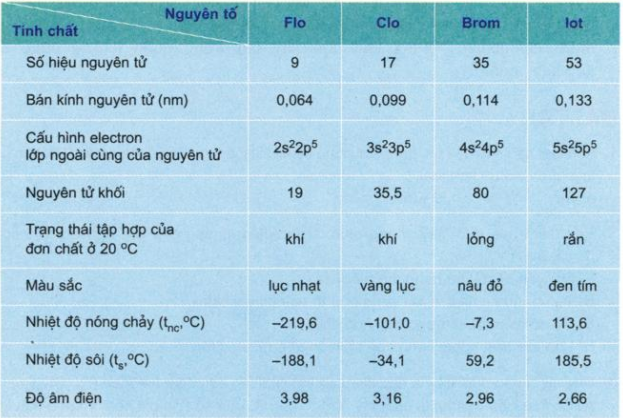
Bảng 1: Một số đặc điểm của các nguyên tố nhóm halogen
1. Sự biến đổi tính chất vật lý của đơn chất
Đi từ flo đến iot ta thấy:
- Trạng thái tập hợp: Từ thể khí chuyển sang thể lỏng và thể rắn.
- Màu sắc: Đậm dần.

- Nhiệt độ nóng chảy và nhiệt độ sôi: Tăng dần.
2. Sự biến đổi độ âm điện
- Độ âm điện của các nguyên tố nhóm halogen tương đối lớn.
- Đi từ flo đến iot độ âm điện giảm dần.
- Flo có độ âm điện lớn nhất nên trong tất cả các hợp chất chỉ có số oxi hóa là -1. Các nguyên tố halogen khác, ngoài số oxi hóa -1 còn có các số oxi hóa +1; +3; +5; +7.
3. Sự biến đổi tính chất hóa học của các đơn chất halogen
- Vì lớp electron ngoài cùng có cấu tạo tương tự nhau (ns2np5) nên các đơn chất halogen giống nhau về tính chất hóa học cũng như thành phần và tính chất của các hợp chất do chúng tạo thành.
- Halogen là các phi kim điển hình. Đi từ flo đến iot tính oxi hóa giảm dần.
- Các halogen oxi hóa được hầu hết các kim loại tạo thành muối halogenua:
2Fe + 3F2 → 2FeF3
2Fe + 3Cl2 2FeCl3
2Fe + 3Br2 2FeBr3
Fe + I2 FeI2
- Các halogen oxi hóa khí hiđro tạo ra những hợp chất khí không màu là hiđro halogenua. Những chất khí này tan trong nước và tạo thành dung dịch axit halogenhiđric:
H2 + F2 2HF (k)
H2 + Cl2 2HCl (k)
H2 + Br2 2HBr (k)
H2 + I2 2HI (k).
Xem thêm các bài tổng hợp lý thuyết Hóa học lớp 10 đầy đủ, chi tiết khác:
Lý thuyết Bài 23: Hiđro clorua – Axit clohiđric và muối clorua
Lý thuyết Bài 24: Sơ lược về hợp chất có oxi của clo
Xem thêm các chương trình khác:
- Giải sgk Vật Lí 10 | Giải bài tập Vật lí 10 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 10
- Tóm tắt tác phẩm Ngữ văn 10
- Soạn văn 10 (hay nhất) | Để học tốt Ngữ Văn 10 (sách mới)
- Soạn văn 10 (ngắn nhất) | Để học tốt Ngữ văn 10 (sách mới)
- Văn mẫu lớp 10 (cả ba sách) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Lịch sử 10 | Giải bài tập Lịch sử 10 Học kì 1, Học kì 2 (sách mới)
