Lý thuyết Hóa 10 Bài 23: Hiđro clorua – Axit clohiđric và muối clorua
Tóm tắt lý thuyết Hóa 10 Bài 23: Hiđro clorua – Axit clohiđric và muối clorua ngắn gọn, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm Hóa 10 Bài 23.
Lý thuyết Hóa 10 Bài 23: Hiđro clorua – Axit clohiđric và muối clorua
Bài giảng Hóa 10 Bài 23: Hiđro clorua – Axit clohiđric và muối clorua
I. Hiđro clorua (HCl)
1. Cấu tạo phân tử
![]() hay H – Cl
hay H – Cl
- Hiđro clorua là hợp chất cộng hóa trị, phân tử có cực ()
2. Tính chất
- Hiđro clorua là chất khí, không màu, mùi xốc, nặng hơn không khí (d = ).
- Khí hiđro clorua tan rất nhiều trong nước. Ở 20oC, 1 thể tích nước có thể hòa tan tới gần 500 thể tích khí hiđroclorua.
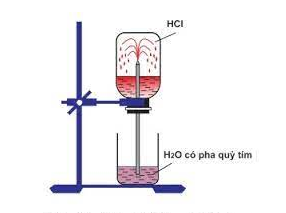
Hình 1: Thí nghiệm về tính dễ tan của khí HCl trong nước
- Giải thích thí nghiệm về tính dễ tan của khí HCl trong nước:
+ Sở dĩ nước phun vào bình thành các tia là do khí HCl tan nhiều trong nước, tạo ra sự giảm mạnh áp suất trong bình, áp suất của khí quyển đẩy nước vào thế chỗ khí HCl đã hòa tan.
+ Dung dịch thu được là axit nên làm quỳ tím chuyển sang màu đỏ.
II – Axit clohiđric
1. Tính chất vật lí
- Hiđro clorua tan vào nước tạo thành dung dịch axit clohiđric.
- Axit clohiđric là chất lỏng, không màu, mùi xốc.
- Dung dịch HCl đặc nhất (ở 20oC) đạt tới nồng độ 37% và có khối lượng riêng D = 1,19 g/cm3.
- Dung dịch HCl đặc “bốc khói” trong không khí ẩm. Đó là do hiđro clorua thoát ra tạo với hơi nước trong không khí thành những hạt dung dịch nhỏ như sương mù.
2. Tính chất hóa học
Axit clohiđric là một axit mạnh, mang đầy đủ tính chất hóa học của một axit như:
- Làm quỳ tím chuyển sang màu đỏ.
- Tác dụng với kim loại đứng trước (H) trong dãy hoạt động hóa học của kim loại. Ví dụ:
Mg + 2HCl → MgCl2 + H2
2Al + 6HCl → 2AlCl3 + 3H2

Hình 2: Mg tác dụng với HCl
Chú ý: Kim loại có nhiều hóa trị tác dụng với dung dịch HCl thu được muối trong đó kim loại ở mức hóa trị thấp. Ví dụ:
Fe + 2HCl → FeCl2 + H2
- Tác dụng với oxit bazơ và bazơ tạo thành muối và nước. Ví dụ:
CuO + 2HCl CuCl2 + H2O
Fe2O3 + 6HCl 2FeCl3 + 3H2O
NaOH + HCl → NaCl + H2O
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
- Tác dụng với muối của axit yếu hơn tạo thành muối mới và axit mới. Ví dụ:
CaCO3 + 2HCl → CaCl2 + H2O + CO2 ↑
AgNO3 + HCl → AgCl↓ + HNO3
Ngoài tính chất đặc trưng là tính axit, dung dịch axit HCl đặc còn thể hiện tính khử khi tác dụng chất oxi hoá mạnh như KMnO4, MnO2, K2Cr2O7, MnO2, KClO3…
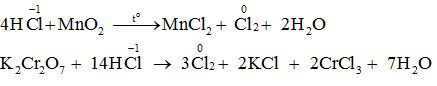
3. Điều chế
a. Trong phòng thí nghiệm
- Điều chế hiđro clorua bằng cách cho tinh thể NaCl vào dung dịch H2SO4 đậm đặc và đun nóng (phương pháp sunfat) rồi hấp thụ vào nước để được axit clohiđric.
- Phương trình hóa học minh họa:
2NaCltt + H2SO4 đặc Na2SO4 + 2HCl ↑
NaCltt + H2SO4 đặc NaHSO4 + HCl ↑
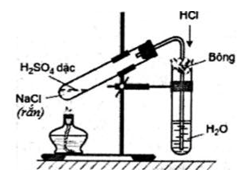
Hình 3: Điều chế axit clohiđric trong phòng thí nghiệm
b. Trong công nghiệp
- Phương pháp tổng hợp: Đốt H2 trong khí quyển Cl2
Phương trình hóa học:
H2 + Cl2 2HCl
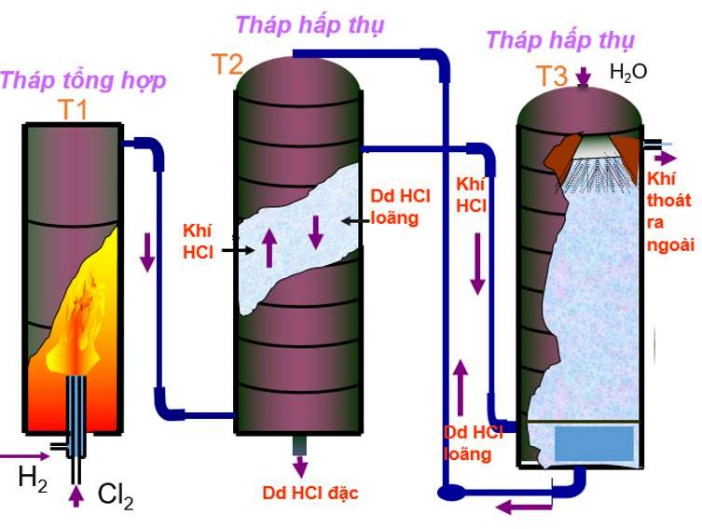
Hình 4: Sơ đồ thiết bị sản xuất axit clohiđric trong công nghiệp
- Phương pháp sunfat: Công nghệ sản xuất từ NaCl rắn và H2SO4 đặc:
2NaCltt + H2SO4 đặc Na2SO4 + 2HCl ↑
- Ngoài ra một lượng lớn HCl thu được trong công nghiệp từ quá trình clo hóa các hợp chất hữu cơ.
III. Muối clorua và nhận biết ion clorua
1. Một số muối clorua
- Muối của axit clohiđric được gọi là muối clorua.
- Công thức tổng quát: MCln.
Trong đó:
+ M là kim loại hoặc NH4+
+ n là hóa trị tương ứng của M
- Đa số các muối clorua tan nhiều trong nước trừ một số muối không tan như AgCl và ít tan như CuCl; PbCl2 …
- Muối clorua có nhiều ứng dụng quan trọng, ví dụ:
+ NaCl: làm muối ăn, bảo quản thực phẩm, là nguyên liệu quan trọng cho ngành công nghiệp hóa chất …
+ KCl: dùng làm phân kali.
+ ZnCl2: chống mục gỗ.
+ AlCl3: chất xúc tác trong tổng hợp hữu cơ.
+ BaCl2: dùng trừ sâu bệnh trong nông nghiệp.
2. Nhận biết ion clorua
- Để nhận biết ion clorua (Cl-) có thể dùng thuốc thử là dung dịch AgNO3 do tạo thành AgCl kết tủa trắng, kết tủa này không tan trong các axit mạnh.
- Phương trình hóa học minh họa:
AgNO3 + NaCl → AgCl↓ + NaNO3
AgNO3 + HCl → AgCl ↓ + HNO3
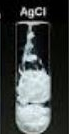
Hình 5: Kết tủa AgCl
Xem thêm các bài tổng hợp lý thuyết Hóa học lớp 10 đầy đủ, chi tiết khác:
Lý thuyết Bài 24: Sơ lược về hợp chất có oxi của clo
Lý thuyết Bài 25: Flo – brom – iot
Xem thêm các chương trình khác:
- Giải sgk Vật Lí 10 | Giải bài tập Vật lí 10 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 10
- Tóm tắt tác phẩm Ngữ văn 10
- Soạn văn 10 (hay nhất) | Để học tốt Ngữ Văn 10 (sách mới)
- Soạn văn 10 (ngắn nhất) | Để học tốt Ngữ văn 10 (sách mới)
- Văn mẫu lớp 10 (cả ba sách) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Lịch sử 10 | Giải bài tập Lịch sử 10 Học kì 1, Học kì 2 (sách mới)
