Giải Hóa 10 Bài 3 (Cánh diều): Nguyên tố hóa học
Với giải bài tập Hóa 10 Bài 3: Nguyên tố hóa học sách Cánh diều hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 10 Bài 3.
Giải bài tập Hóa lớp 10 Bài 3: Nguyên tố hóa học
Video giải bài tập Hóa lớp 10 Bài 3: Nguyên tố hóa học
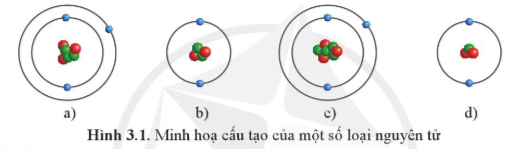
Mở đầu trang 16 Hóa học 10: Những nguyên tử nào dưới đây thuộc cùng một nguyên tố hóa học?
Trả lời:
Các nguyên tử mà hạt nhân có cùng số proton thuộc cùng một nguyên tố hóa học.
⇒ Nguyên tử ở hình a) và c) thuộc cùng một nguyên tố hóa học vì cùng có 3 proton (hạt màu đỏ) trong hạt nhân.
Nguyên tử ở hình b) và d) thuộc cùng một nguyên tố hóa học vì cùng có 2 proton (hạt màu đỏ) trong hạt nhân.
I. Nguyên tố hóa học
1. Khái niệm nguyên tố hóa học
Câu hỏi 1 trang 16 Hóa học 10: Nguyên tử lithium (Li) có 3 proton trong hạt nhân. Khi Li tác dụng với khí chlorine (Cl2) sẽ thu được muối lithium chloride (LiCl), trong đó, Li tồn tại ở dạng ion Li+. Ion Li+ có bao nhiêu proton trong hạt nhân?
Trả lời:
Khi hình thành muối lithium chloride (LiCl) nguyên tử Li cho đi 1 electron ở lớp ngoài cùng trở thành ion mang điện tích dương, kí hiệu là Li+.
Như vậy nguyên tử Li chỉ nhường electron ở lớp vỏ, số proton không thay đổi. Hay ion Li+ có 3 proton trong hạt nhân.
2. Số hiệu nguyên tử, số khối, kí hiệu nguyên tử
Trả lời:
Số hiệu nguyên tử = số proton = số electron = 1288=16.
Trả lời:
Khối lượng nguyên tử (gần đúng) ≈ khối lượng hạt nhân nguyên tử = Z + N (amu)
Số khối = Z + N
Ta thấy: Khối lượng nguyên tử xấp xỉ bằng số khối.
Câu hỏi 2 trang 17 Hóa học 10: Một loại nguyên tử lithium có 3 proton và 4 neutron. Viết kí hiệu nguyên tử của lithium đó.
Trả lời:
Lithium có:
+ Số hiệu nguyên tử (Z) = số proton = 3.
+ Số khối (A) = 3 + 4 = 7.
Kí hiệu nguyên tử Li là L73i
Luyện tập 3 trang 17 Hóa học 10: Hoàn thành bảng sau:
Chú ý:
+ Số hiệu nguyên tử (Z) = số proton
+ Số neutron = số khối (A) – số proton.
|
Nguyên tử |
Số p |
Số n |
Kí hiệu nguyên tử |
|
C |
6 |
6 |
C126 |
|
Na |
11 |
12 |
X2311 |
II. Đồng vị, nguyên tử khối trung bình
1. Đồng vị
Câu hỏi 3 trang 18 Hóa học 10: Cho các nguyên tử sau: X52; Y73; Z94; M115; T125. Những nguyên tử nào là đồng vị của nhau?
Trả lời:
Nguyên tử M115và T125 là đồng vị của nhau vì cùng có 5 proton trong hạt nhân nhưng khác nhau về số neutron (M có 6 neutron còn T có 7 neutron).
Trả lời:
Ta có: 1 ≤ NZ ≤ 1,25
⇔ Z ≤ N ≤ 1,25Z
⇔ Z + Z ≤ N + Z ≤ 1,25Z + Z
⇔ 8 + 8 ≤ A ≤ 1,25.8 + 8
⇔ 16 ≤ A ≤ 18
Vậy trong tự nhiên thường gặp các đồng vị: O168; O178; O188của oxygen.
Trả lời:
Trong tự nhiên oxygen có các đồng vị là O168; O178; O188. Trong đó đồng vị O168 chiếm nhiều nhất trong tự nhiên (khoảng 99,762%).
2. Nguyên tử khối trung bình
Luyện tập 4 trang 18 Hóa học 10: Trong tự nhiên, argon có các đồng vị A40r, A38r, A36r chiếm tương ứng khoảng 99,604%, 0,063% và 0,333% số nguyên tử. Tính nguyên tử khối trung bình của Ar.
Trả lời:
Nguyên tử khối trung bình của argon là:
40×99,604+38×0,063+36×0,33399,604+0,063+0,333 ≈ 39,99
Câu hỏi 4 trang 18 Hóa học 10: Chlorine có hai đồng vị bền là C35l và C37l. Nguyên tử khối trung bình của chlorine là 35,45. Tính tỉ lệ phần trăm số nguyên tử mỗi đồng vị của chlorine trong tự nhiên.
Trả lời:
Đặt phần trăm số nguyên tử của đồng vị C35l là x
Đặt phần trăm số nguyên tử của đồng vị C37l là y
Ta có: x + y = 100 (1)
Nguyên tử khối trung bình của chlorine là:
35×x+37×y100=35,45 (2)
Giải hệ (1) và (2) ta được: x = 77,5 và y = 22,5
Vậy phần trăm số nguyên tử của đồng vị C35l là 77,5%
Phần trăm số nguyên tử của đồng vị C37l là 22,5%
Bài tập (trang 20)
Bài 1 trang 20 Hóa học 10: Hoàn thành bảng sau đây:
Trả lời:
Chú ý:
+ Số hiệu nguyên tử (Z) = số proton = số electron.
+ Số neutron (N) = số khối (A) – số hiệu nguyên tử (Z)
+ Kí hiệu nguyên tử: XAZ
|
Kí hiệu |
Số hiệu nguyên tử |
Số khối |
Số proton |
Số electron |
Số neutron |
|
18 |
40 |
18 |
18 |
22 |
|
|
K3919 |
19 |
39 |
19 |
19 |
20 |
|
S3616 |
16 |
36 |
16 |
16 |
20 |
Bài 2 trang 20 Hóa học 10: Phát biểu nào sau đây là đúng?
A. Những nguyên tử có cùng số electron thuộc cùng một nguyên tố hóa học.
C. Những nguyên tử có cùng số neutron thì thuộc cùng một nguyên tố hóa học.
Trả lời:
Đáp án đúng là: A
A. Đúng. Những nguyên tử có cùng số proton thì thuộc cùng một nguyên tố hóa học.
Mà nguyên tử trung hòa về điện nên số proton = số electron
Trả lời:
Đặt phần trăm số nguyên tử của đồng vị C63u là x
Đặt phần trăm số nguyên tử của đồng vị C65u là y
Ta có: x + y = 100 (1)
63×x+65×y100=63,54 (2)
Giải hệ (1) và (2) ta được: x = 73 và y = 27
Vậy phần trăm số nguyên tử của đồng vị C63u là 73%
Phần trăm số nguyên tử của đồng vị C65u là 27%
Số mol tương ứng với 6,354 gam đồng là 6,35463,54 = 0,1 mol
Số mol đồng vị C63u trong 6,354 gam đồng là 73.0,1100 = 0,073 mol
Số mol đồng vị C65u trong 6,354 gam đồng là 27.0,1100 = 0,027 mol
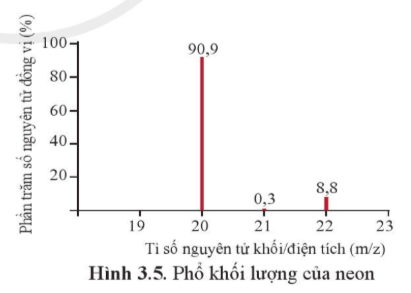
a) Neon có bao nhiêu đồng vị bền?
b) Tính nguyên tử khối trung bình của neon.
Trả lời:
a) Neon có 3 đồng vị bền: N20e (90,9%), N21e (0,3%), N22e (8,8%)
b) Nguyên tử khối trung bình của neon là
20×90,9+21×0,3+22×8,8100 = 20,179
Lý thuyết Nguyên tố hóa học
I. Nguyên tố hóa học
1. Khái niệm nguyên tố hóa học
- Nguyên tố hóa học là tập hợp các nguyên tử có cùng số hạt proton.
Ví dụ: Ba loại nguyên tử trong hình dưới đây đều có một proton (hạt màu xanh) trong hạt nhân nên thuộc cùng một nguyên tố hóa học, nguyên tố hydrogen (H).
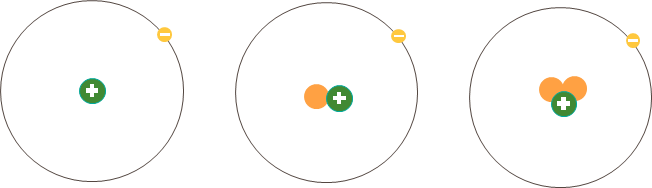
Hình 3.1. Minh họa cấu tạo một số loại nguyên tử của nguyên tố hydrogen
2. Số hiệu nguyên tử, số khối, kí hiệu nguyên tử
- Số proton trong một hạt nhân nguyên tử được gọi là số hiệu nguyên tử, kí hiệu là Z.
Ví dụ: Hạt nhân nguyên tử lithium (Li) có 3 proton, vậy số hiệu nguyên tử của Li là 3 (ZLi = 3).
- Tổng số proton (Z) và neutron (N) trong một hạt nhân nguyên tử được gọi là số khối, kí hiệu là A.
A = Z + N
Như vậy, số khối chính bằng tổng số hạt có trong hạt nhân nguyên tử. Giá trị này xấp xỉ bằng giá trị khối lượng nguyên tử (tính theo đơn vị amu).
Ví dụ: Một loại nguyên tử sodium (Na) có 11 hạt proton, 11 electron và 12 hạt neutron. Số khối của nguyên tử Na = Z + N = P + N = 11 + 12 = 23 (amu)
- Kí hiệu nguyên tử ZAZ cho biết kí hiệu hóa học của nguyên tố (X), số hiệu nguyên tử (Z) và số khối (A).

Hình 3.2. Kí hiệu nguyên tử của helium
Lưu ý: Đôi khi, người ta viết tắt kí hiệu nguyên tử.
Ví dụ: Sử dụng 4He thay cho H42e , bởi kí hiệu He đã cho biết đây là nguyên tử nguyên tố helium, hạt nhân có 2 proton.
II. Đồng vị, nguyên tử khối trung bình
1. Đồng vị
- Các nguyên tử của cùng một nguyên tố hóa học có số neutron khác nhau là đồng vị của nhau.
Do đó, đồng vị của cùng một nguyên tố hóa học (có cùng số proton) khác nhau về số khối do đó số neutron khác nhau.
Ví dụ: Helium có hai đồng vị bền là H32e và H42e.
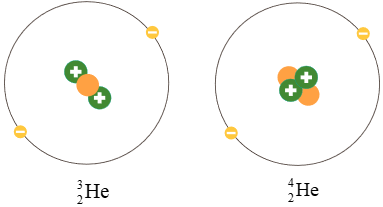
Hình 3.3. Minh họa cấu tạo nguyên tử hai đồng vị của nguyên tố helium
- Tất cả các nguyên tố hóa học đều có nhiều đồng vị.
Ví dụ: Hydrogen có ba đồng vị là H11(kí hiệu là H), H21(kí hiệu là D), H31(kí hiệu là T), oxygen có 17 đồng vị bắt đầu từ O128 và kết thúc là O288, ...
2. Nguyên tử khối trung bình
a) Nguyên tử khối
- Nguyên tử khối là khối lượng tương đối của một nguyên tử, cho biết khối lượng của một nguyên tử nặng gấp bao nhiêu lần 1 amu.
Ví dụ: Nguyên tử khối của 16O là 16 do khối lượng của một nguyên tử 16O là 16 amu.
b) Nguyên tử khối trung bình
- Mỗi nguyên tố hóa học đều có nhiều đồng vị.
- Trong tự nhiên, một nguyên tố hóa học dù ở dạng đơn chất hay hợp chất thì tỉ lệ giữa các đồng vị của nguyên tố này là không đổi.
- Nguyên tử khối của nguyên tố hóa học có nhiều đồng vị là nguyên tử khối trung bình của các đồng vị (kí hiệu là ![]() ), có tính đến tỉ lệ số nguyên tử các đồng vị tương ứng (xác định từ phổ khối lượng).
), có tính đến tỉ lệ số nguyên tử các đồng vị tương ứng (xác định từ phổ khối lượng).
- Công thức tính nguyên tử khối trung bình như sau:
ˉA = X×x+Y×y+Z×z+...x+y+z+...
Trong đó:
+ X, Y, Z, ... lần lượt là số khối của các đồng vị.
+ x, y, z, ... là phần trăm số nguyên tử các đồng vị tương ứng.
Ví dụ: Trong tự nhiên, đồng có hai đồng vị bền là 63Cu và 65Cu chiếm tương ứng khoảng 73% và 27% về số nguyên tử. Nguyên tử khối trung bình của đồng là:
ˉA = 63×73+65×2773+27= 63,64
Lưu ý: Nguyên tử khối của một nguyên tố hóa học ghi trong bảng tuần hoàn là nguyên tử khối trung bình của các đồng vị trong tự nhiên.
Xem thêm lời giải bài tập Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 4: Mô hình nguyên tử và orbital nguyên tử
Bài 5: Lớp, phân lớp và cấu hình electron
Bài 6: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Bài 8: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Xem thêm tài liệu Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Cánh Diều
- Tác giả tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Tóm tắt tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Bố cục tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Soạn văn lớp 10 (ngắn nhất) – Cánh Diều
- Giải sbt Ngữ văn lớp 10 – Cánh Diều
- Văn mẫu lớp 10 – Cánh Diều
- Giải Chuyên đề học tập Ngữ văn 10 – Cánh diều
- Giải sgk Toán 10 – Cánh Diều
- Giải Chuyên đề Toán 10 – Cánh Diều
- Lý thuyết Toán 10 – Cánh Diều
- Giải sbt Toán 10 – Cánh Diều
- Chuyên đề dạy thêm Toán 10 Cánh diều (2024 có đáp án)
- Giải sgk Tiếng Anh 10 – Explore new worlds
- Giải sgk Tiếng Anh 10 – ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh 10 ilearn Smart World đầy đủ nhất
- Ngữ pháp Tiếng Anh 10 i-learn Smart World
- Giải sbt Tiếng Anh 10 - iLearn Smart World
- Giải sgk Vật lí 10 – Cánh Diều
- Giải sbt Vật lí 10 – Cánh Diều
- Lý thuyết Vật lí 10 – Cánh Diều
- Giải Chuyên đề Vật lí 10 – Cánh Diều
- Giải sgk Sinh học 10 – Cánh Diều
- Giải sbt Sinh học 10 – Cánh Diều
- Lý thuyết Sinh học 10 – Cánh Diều
- Giải Chuyên đề Sinh học 10 – Cánh diều
- Giải sgk Lịch sử 10 – Cánh Diều
- Giải sbt Lịch sử 10 – Cánh Diều
- Giải Chuyên đề Lịch sử 10 – Cánh Diều
- Lý thuyết Lịch sử 10 – Cánh diều
- Giải sgk Địa lí 10 – Cánh Diều
- Lý thuyết Địa Lí 10 – Cánh Diều
- Giải sbt Địa lí 10 – Cánh Diều
- Giải Chuyên đề Địa lí 10 – Cánh Diều
- Lý thuyết Công nghệ 10 – Cánh Diều
- Giải sgk Công nghệ 10 – Cánh Diều
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Cánh Diều
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Cánh Diều
- Giải Chuyên đề Kinh tế pháp luật 10 – Cánh diều
- Lý thuyết KTPL 10 – Cánh diều
- Lý thuyết Giáo dục quốc phòng 10 – Cánh Diều
- Giải sgk Giáo dục quốc phòng - an ninh 10 – Cánh diều
- Giải sbt Giáo dục quốc phòng - an ninh 10 – Cánh Diều
- Giải sgk Hoạt động trải nghiệm 10 – Cánh Diều
- Giải sbt Hoạt động trải nghiệm 10 – Cánh Diều
- Giải sgk Tin học 10 – Cánh Diều
- Giải sbt Tin học 10 – Cánh Diều
- Giải Chuyên đề Tin học 10 – Cánh diều
- Lý thuyết Tin học 10 - Cánh diều
- Giải sgk Giáo dục thể chất 10 – Cánh Diều