Giải Hóa 10 Bài 5 ( Cánh diều): Lớp, phân lớp và cấu hình electron
Với giải bài tập Hóa 10 Bài 5: Lớp, phân lớp và cấu hình electron sách Cánh diều hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 10 Bài 5.
Giải bài tập Hóa lớp 10 Bài 5: Lớp, phân lớp và cấu hình electron
Video giải bài tập Hóa lớp 10 Bài 5: Lớp, phân lớp và cấu hình electron
Trả lời:
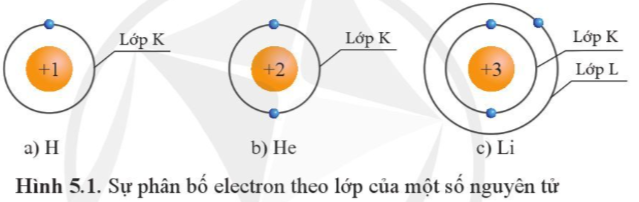
- Trong hình 5.1 có He (Z = 2) và Li (Z > 2), ta thấy lớp K của 2 nguyên tử này đều có 2 electron ⇒ số electron tối đa ở lớp K của các nguyên tử có số hiệu nguyên tử Z ≥ 2 là 2.
- Thứ tự phân bố electron vào lớp vỏ nguyên tử: Các electron sẽ được phân bố lần lượt vào các lớp theo chiều từ gần hạt nhân ra ngoài. Mỗi lớp có số electron đối đa xác định, như lớp thứ nhất có tối đa 2 electron, lớp thứ 2 có tối đa 8 electron,…
I. Lớp và phân lớp electron
1. Lớp electron
Trả lời:
Vì mỗi AO chứa tối đa 2 electron nên số AO trong một lớp luôn bằng một nửa số electron tối đa thuộc lớp đó.
Trả lời:
Số hiệu nguyên tử (Z) = số electron ⇒ Nitrogen có 7 electron được phân bố vào 2 lớp:
+ Lớp thứ nhất chứa 2 electron, phân bố vào 1 AO.
+ Lớp thứ hai chứa 5 electron, phân bố vào 4 AO.
Như vậy lớp ngoài cùng của nitrogen chứa 5 electron, phân bố vào 4 AO.
2. Phân lớp electron
Trả lời:
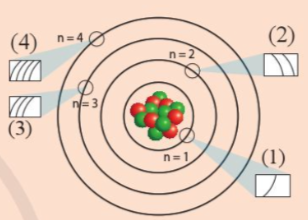
Các ô (1), (2), (3), (4) trong hình liên hệ với phân lớp electron.
Chú ý:
Lớp K, n =1 có 1 phân lớp,
Lớp L, n = 2 có 2 phân lớp,
Lớp M, n = 3 có 3 phân lớp,
Lớp N, n = 4 có 4 phân lớp.
Trả lời:
Lớp electron thứ tư (n = 4) có 4 phân lớp. Kí hiệu là 4s, 4p, 4d và 4f.
Câu hỏi 4 trang 27 Hóa học 10: Tính số electron tối đa (bão hòa) trên mỗi phân lớp ns, np, nd, nf
Trả lời:
Vì mỗi AO chứa tối đa 2 electron nên ta có:
|
Phân lớp |
ns |
np |
nd |
nf |
|
Số AO |
1 |
3 |
5 |
7 |
|
Số electron tối đa (bão hòa) |
2 |
6 |
10 |
14 |
II. Cấu hình electron nguyên tử
1. Cách viết cấu hình electron nguyên tử
Trả lời:
|
Số hiệu nguyên tử (Z) |
Cấu hình electron |
|
1 |
1s1 |
|
2 |
1s2 |
|
3 |
1s22s1 |
|
4 |
1s22s2 |
|
5 |
1s22s22p1 |
|
6 |
1s22s22p2 |
|
7 |
1s22s22p3 |
|
8 |
1s22s22p4 |
|
9 |
1s22s22p5 |
|
10 |
1s22s22p6 |
|
11 |
1s22s22p63s1 |
|
12 |
1s22s22p63s2 |
|
13 |
1s22s22p63s23p1 |
|
14 |
1s22s22p63s23p2 |
|
15 |
1s22s22p63s23p3 |
|
16 |
1s22s22p63s23p4 |
|
17 |
1s22s22p63s23p5 |
|
18 |
1s22s22p63s23p6 |
|
19 |
1s22s22p63s23p64s1 |
|
20 |
1s22s22p63s23p64s2 |
2. Biểu diễn cấu hình electron theo ô orbital
|
Số hiệu nguyên tử Z |
Orbital lớp ngoài cùng |
Số electron độc thân |
|
1 |
|
1 |
|
2 |
|
0 |
|
3 |
|
1 |
|
4 |
|
0 |
|
5 |
|
1 |
|
6 |
|
2 |
|
7 |
|
3 |
|
8 |
|
2 |
|
9 |
|
1 |
|
10 |
|
0 |
|
11 |
|
1 |
|
12 |
|
0 |
|
13 |
|
1 |
|
14 |
|
2 |
|
15 |
|
3 |
|
16 |
|
2 |
|
17 |
|
1 |
|
18 |
|
0 |
|
19 |
|
1 |
|
20 |
|
0 |
III. Dự đoán tính chất hóa học cơ bản của nguyên tố dựa theo cấu hình electron của nguyên tử
Trả lời:
|
Số hiệu nguyên tử (Z) |
Cấu hình electron |
Tính chất hóa học cơ bản |
|
1 |
1s1 |
Tính phi kim |
|
2 |
1s2 |
Khí hiếm (tính trơ) |
|
3 |
1s22s1 |
Tính kim loại |
|
4 |
1s22s2 |
Tính kim loại |
|
5 |
1s22s22p1 |
Tính phi kim |
|
6 |
1s22s22p2 |
Tính phi kim |
|
7 |
1s22s22p3 |
Tính phi kim |
|
8 |
1s22s22p4 |
Tính phi kim |
|
9 |
1s22s22p5 |
Tính phi kim |
|
10 |
1s22s22p6 |
Khí hiếm (tính trơ) |
|
11 |
1s22s22p63s1 |
Tính kim loại |
|
12 |
1s22s22p63s2 |
Tính kim loại |
|
13 |
1s22s22p63s23p1 |
Tính kim loại |
|
14 |
1s22s22p63s23p2 |
Tính phi kim |
|
15 |
1s22s22p63s23p3 |
Tính phi kim |
|
16 |
1s22s22p63s23p4 |
Tính phi kim |
|
17 |
1s22s22p63s23p5 |
Tính phi kim |
|
18 |
1s22s22p63s23p6 |
Khí hiếm (Tính trơ) |
|
19 |
1s22s22p63s23p64s1 |
Tính kim loại |
|
20 |
1s22s22p63s23p64s2 |
Tính kim loại |
Bài tập (trang 30)
Bài 1 trang 30 Hóa học 10: Những phát biểu nào sau đây là đúng?
(a) Orbital 1s có dạng hình cầu, orbital 2s có dạng hình số tám nổi.
(*) Ngoại trừ nguyên tử H có năng lượng các phân lớp trong một lớp là bằng nhau.
Trả lời:
(a) Sai. Các orbital s đều có dạng hình cầu.
(b) Đúng.
(c) Sai. Các electron thuộc cùng một lớp có năng lượng gần bằng nhau.
(d) Đúng.
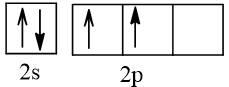
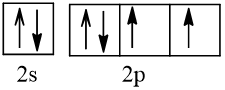
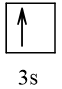
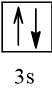
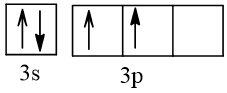
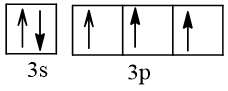
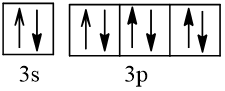
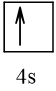
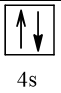
Bài 2 trang 30 Hóa học 10: Nguyên tử nguyên tố X có hai lớp electron, trong đó có một electron độc thân. Vậy X có thể là những nguyên tố nào?
Trả lời:
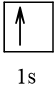
Cấu hình electron theo orbital của nguyên tố X có thể là
Vậy X có thể là Z = 3 (Li) hoặc Z = 5 (Bo) hoặc Z = 9 (F).
Bài 3* trang 30 Hóa học 10: Cấu hình electron của các ion được thiết lập bằng cách nhận hoặc nhường electron, bắt đầu từ phân lớp ngoài cùng của cấu hình electron nguyên tử tương ứng.
a) Viết cấu hình electron của ion Na+ và ion Cl-.
b) Nguyên tử Cl nhận 1 electron để trở thành ion Cl-, electron này xếp vào AO thuộc phân lớp nào của Cl? AO đó là AO trống, chứa 1 hay 2 electron?
Trả lời:
a) Cấu hình electron của Na (Z = 11): 1s22s22p63s1. Nguyên tử Na nhường 1 electron để được ion Na+.
⇒ Cấu hình electron của Na+ là 1s22s22p6.
Cấu hình electron của Cl (Z = 17): 1s22s22p63s23p5. Nguyên tử Cl nhận 1 electron để được ion Cl‑.
⇒ Cấu hình electron của Cl- là 1s22s22p63s23p6
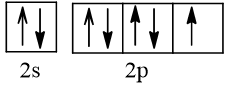
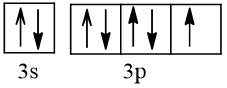
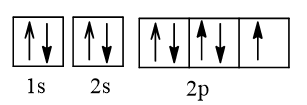
b) Cấu hình theo orbital lớp ngoài cùng của nguyên tử Cl
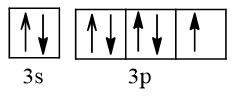
Nguyên tử Cl nhận 1 electron để trở thành ion Cl-, electron này xếp vào AO thuộc phân lớp 3p của Cl. AO đó là AO chứa 1 electron.
Lý thuyết Lớp, phân lớp và cấu hình electron
I. Lớp và phân lớp electron
Các electron trong lớp vỏ nguyên tử được phân bố vào các lớp và phân lớp dựa theo năng lượng của chúng.
1. Lớp electron
- Các electron thuộc cùng một lớp có năng lượng gần bằng nhau.
- Trong mỗi lớp electron, có thể có một hoặc nhiều AO.
Bảng 5.1. Số lượng AO và số electron tối đa trong mỗi lớp
|
Lớp |
K (n = 1) |
L (n = 2) |
M (n = 3) |
N (n = 4) |
|
Số lượng AO |
1 |
4 |
9 |
16 |
|
Số electron tối đa |
2 |
8 |
18 |
32 |
- Số electron và số lượng AO trong lớp thứ n (n £ 4) được ghi nhớ theo quy tắc sau:
+ Lớp thứ n có n2 AO.
+ Lớp thứ n có tối đa 2n2 electron.
Ví dụ: Dựa vào công thức này tính được lớp thứ tư (lớp N, n = 4) có 42 = 16 AO và chứa tối đa 2.42 = 32 electron.
Lưu ý: Năng lượng của một electron phụ thuộc vào khoảng cách từ electron đó tới hạt nhân. Electron càng xa hạt nhân thì có năng lượng càng cao.
Ví dụ: Các lớp electron xếp theo thứ tự mức năng lượng từ thấp đến cao: K, L, M, N ..
2. Phân lớp electron
- Mỗi lớp electron (trừ lớp thứ nhất) lại được chia thành các phân lớp theo nguyên tắc: Các electron thuộc cùng một phân lớp có năng lượng bằng nhau.
- Số lượng và kí hiệu các phân lớp trong một lớp: Lớp electron thứ n có n phân lớp và được kí hiệu lần lượt là ns, np, nd, nf, ... Cụ thể:
+ Lớp K (n =1): có 1 phân lớp, được kí hiệu là 1s.
+ Lớp L (n =2): có 2 phân lớp, được kí hiệu là 2s và 2p.
+ Lớp M (n =3): có 3 phân lớp, được kí hiệu là 3s, 3p và 3d.
- Số lượng AO trong mỗi phân lớp
+ Phân lớp ns chỉ có 1 AO.
+ Phân lớp np có 3 AO.
+ Phân lớp nd có 5 AO.
+ Phân lớp nf có 7 AO.
- Số electron trong mỗi phân lớp được biểu diễn bằng chỉ số phía trên, bên phải kí hiệu phân lớp. Phân lớp nào đã có tối đa electron được gọi là phân lớp bão hòa.
Ví dụ: Kí hiệu 1s2 cho biết phân lớp 1s có 2 electron. Do phân lớp 1s chỉ có 1 AO nên phân lớp 1s chứa tối đa 2 electron, 1s2 được gọi là phân lớp bão hòa.
Lưu ý: Số lượng electron tối đa trong mỗi phân lớp
- Phân lớp ns chứa tối đa 2 electron.
- Phân lớp np chứa tối đa 6 electron.
- Phân lớp nd chứa tối đa 10 electron.
- Phân lớp nf chứa tối đa 14 electron.
II. Cấu hình electron nguyên tử
1. Cách viết cấu hình electron nguyên tử
- Cấu hình electron biểu diễn sự phân bố electron vào lớp vỏ nguyên tử theo các lớp và phân lớp.
- Các bước viết cấu hình electron nguyên tử theo những nguyên tắc sau:
+ Quy tắc 1: Điền electron theo thứ tự các mức năng lượng từ thấp đến cao (dãy Klechkovski):
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s...
Điền electron bão hòa phân lớp trước rồi mới điền tiếp vào phân lớp sau.
- Quy tắc 2: Đổi lại vị trí các phân lớp sao cho số thứ tự lớp (n) tăng dần từ trái qua phải, các phân lớp trong cùng một lớp theo thứ tự s, p, d, f.
Ví dụ: Nguyên tử Fe có Z = 26, sau khi điền electron vào dãy Klechkovski nhận được dãy 1s22s22p63s23p64s23d6. Sắp xếp lại vị trí phân lớp 4s2 và 3d6 thu được cấu hình electron là 1s22s22p63s23p63d64s2.
- Cấu hình electron cho biết thứ tự mức năng lượng các electron giữa các phân lớp. Năng lượng của electron trong mỗi phân lớp tăng theo chiều từ trái qua phải.
Ví dụ: Cấu hình electron nguyên tử của oxygen là 1s22s22p4. Trong nguyên tử oxygen, năng lượng của electron thuộc phân lớp 2s cao hơn electron thuộc phân lớp 1s, năng lượng của electron thuộc phân lớp 2p cao hơn electron thuộc phân lớp 2s.
Lưu ý: Quy tắc đường chéo xác định dãy Klechkovski như sau:
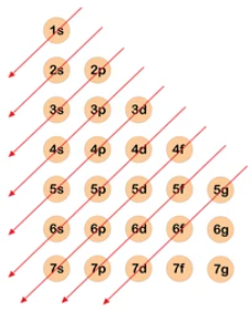
Hình 5.1. Quy tắc đường chéo xác định dãy Klechkovski
2. Biểu diễn cấu hình electron theo ô orbital
- Biểu diễn cấu hình electron theo orbital (còn gọi là cách biểu diễn cấu hình theo ô lượng tử) là một cách biểu diễn sự phân bố electron theo orbital, từ đó biết được nguyên tử có bao nhiêu electron độc thân, electron độc thân đó nằm ở orbital nào.
- Quy tắc biểu diễn cấu hình electron theo orbital:
+ Quy tắc 1: Viết cấu hình electron của nguyên tử
+ Quy tắc 2: Biểu diễn mỗi AO bằng một ô vuông (orbital hay ô lượng tử), các AO trong cùng phân lớp thì viết liền nhau, các AO khác phân lớp thì viết tách nhau. Thứ tự các ô orbital từ trái sang phải theo thứ tự như ở cấu hình electron.
+ Quy tắc 3: Điền electron vào từng ô orbital theo thứ tự lớp và phân lớp, mỗi electron biểu diễn bằng một mũi tên.
Lưu ý:
- Trong mỗi phân lớp, electron được phân bố sao cho số electron độc thân là lớn nhất, electron được điền vào các orbital theo thứ tự từ trái sang phải.
- Trong một ô orbital, electron đầu tiên được biểu diễn bằng mũi tên quay lên, electron thứ hai được biểu diễn bằng mũi tên quay xuống.
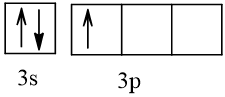
Ví dụ:
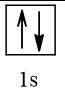
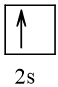
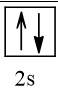
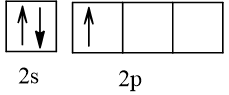
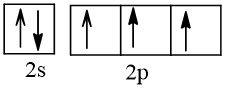
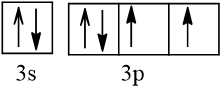
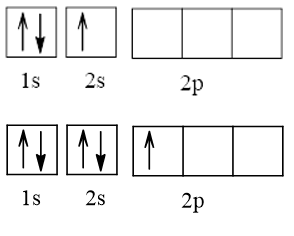
+ Nguyên tử O (Z = 8) có cấu hình electron nguyên tử là 1s22s22p4.
+ Cấu hình theo orbital của O như sau:
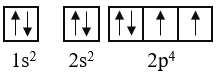
Như vậy, nguyên tử oxygen có 2 elctron độc thân, thuộc AO 2p.
Mở rộng: Electron mang điện tích âm nên hai electron trong cùng một AO sẽ đẩy nhau, vì vậy chúng có xu hướng tách nhau ra và chiếm hai AO khác nhau. Đây là lí do vì sao trong một phân lớp, các electron cần được sắp xếp sao cho số electron độc thân là lớn nhất.
III. Dự đoán tính chất hóa học cơ bản của nguyên tố dựa theo cấu hình electron của nguyên tử
Các electron thuộc lớp ngoài cùng có vai trò quyết định đến tính chất hóa học đặc trưng của nguyên tố (tính kim loại, tính phi kim, tính trơ, ...). Từ cấu hình electron có thể dự đoán các tính chất này theo quy tắc sau:
- Quy tắc 1: Các nguyên tử có 1, 2 hoặc 3 electron ở lớp ngoài cùng thường là các nguyên tử nguyên tố kim loại. Tính kim loại thể hiện qua khả năng nhường electron trong các phản ứng hóa học (tính khử).
Ví dụ: Nguyên tử Na (Z =11) có 1 electron ở lớp ngoài cùng nên Na là nguyên tố kim loại.
- Quy tắc 2: Các nguyên tử có 5, 6 hoặc 7 electron ở lớp ngoài cùng thường là các nguyên tử nguyên tố phi kim. Tính phi kim thể hiện qua khả năng nhận electron trong các phản ứng hóa học (tính oxi hóa).
Ví dụ: Nguyên tử O (Z = 8) có 6 electron ở lớp ngoài cùng nên O là nguyên tố phi kim.
- Quy tắc 3: Các nguyên tử có 8 electron ở lớp ngoài cùng (trừ He chỉ có 2 electron) là các nguyên tử nguyên tố khí hiếm. Các nguyên tố này rất khó tham gia các phản ứng hóa học (tính trơ).
Ví dụ: Nguyên tử Ne (Z = 10) có 8 electron ở lớp ngoài cùng nên Ne là nguyên tố khí hiếm.
- Quy tắc 4: Nếu lớp electron ngoài cùng của một nguyên tử có 4 electron thì nguyên tử nguyên tố đó có thể là kim loại hoặc phi kim.
Xem thêm lời giải bài tập Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 6: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Bài 8: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Xem thêm tài liệu Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Cánh Diều
- Tác giả tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Tóm tắt tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Bố cục tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Soạn văn lớp 10 (ngắn nhất) – Cánh Diều
- Giải sbt Ngữ văn lớp 10 – Cánh Diều
- Văn mẫu lớp 10 – Cánh Diều
- Giải Chuyên đề học tập Ngữ văn 10 – Cánh diều
- Giải sgk Toán 10 – Cánh Diều
- Giải Chuyên đề Toán 10 – Cánh Diều
- Lý thuyết Toán 10 – Cánh Diều
- Giải sbt Toán 10 – Cánh Diều
- Chuyên đề dạy thêm Toán 10 Cánh diều (2024 có đáp án)
- Giải sgk Tiếng Anh 10 – Explore new worlds
- Giải sgk Tiếng Anh 10 – ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh 10 ilearn Smart World đầy đủ nhất
- Ngữ pháp Tiếng Anh 10 i-learn Smart World
- Giải sbt Tiếng Anh 10 - iLearn Smart World
- Giải sgk Vật lí 10 – Cánh Diều
- Giải sbt Vật lí 10 – Cánh Diều
- Lý thuyết Vật lí 10 – Cánh Diều
- Giải Chuyên đề Vật lí 10 – Cánh Diều
- Giải sgk Sinh học 10 – Cánh Diều
- Giải sbt Sinh học 10 – Cánh Diều
- Lý thuyết Sinh học 10 – Cánh Diều
- Giải Chuyên đề Sinh học 10 – Cánh diều
- Giải sgk Lịch sử 10 – Cánh Diều
- Giải sbt Lịch sử 10 – Cánh Diều
- Giải Chuyên đề Lịch sử 10 – Cánh Diều
- Lý thuyết Lịch sử 10 – Cánh diều
- Giải sgk Địa lí 10 – Cánh Diều
- Lý thuyết Địa Lí 10 – Cánh Diều
- Giải sbt Địa lí 10 – Cánh Diều
- Giải Chuyên đề Địa lí 10 – Cánh Diều
- Lý thuyết Công nghệ 10 – Cánh Diều
- Giải sgk Công nghệ 10 – Cánh Diều
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Cánh Diều
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Cánh Diều
- Giải Chuyên đề Kinh tế pháp luật 10 – Cánh diều
- Lý thuyết KTPL 10 – Cánh diều
- Lý thuyết Giáo dục quốc phòng 10 – Cánh Diều
- Giải sgk Giáo dục quốc phòng - an ninh 10 – Cánh diều
- Giải sbt Giáo dục quốc phòng - an ninh 10 – Cánh Diều
- Giải sgk Hoạt động trải nghiệm 10 – Cánh Diều
- Giải sbt Hoạt động trải nghiệm 10 – Cánh Diều
- Giải sgk Tin học 10 – Cánh Diều
- Giải sbt Tin học 10 – Cánh Diều
- Giải Chuyên đề Tin học 10 – Cánh diều
- Lý thuyết Tin học 10 - Cánh diều
- Giải sgk Giáo dục thể chất 10 – Cánh Diều