TOP 15 câu Trắc nghiệm Lớp, phân lớp và cấu hình electron (có đáp án) – Hoá 10 Cánh diều
Bộ 40 bài tập trắc nghiệm Hoá học lớp 10 Bài 5: Lớp, phân lớp và cấu hình electron có đáp án đầy đủ các mức độ sách Cánh diều giúp học sinh ôn luyện trắc nghiệm Hoá học 10 Bài 5.
Chỉ 150k mua trọn bộ Trắc nghiệm Hóa lớp 10 Cánh diều bản word (cả năm) có đáp án chi tiết:
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận tài liệu.
Xem thử tài liệu tại đây: Link tài liệu
Trắc nghiệm Hoá học 10 Bài 5. Lớp, phân lớp và cấu hình electron
Câu 1. Các electron trong lớp vỏ nguyên tử được phân bố vào các lớp và phân lớp dựa theo
A. năng lượng;
B. khối lượng;
C. kích thước;
D. thể tích.
Đáp án: A
Giải thích:
Các electron trong lớp vỏ nguyên tử được phân bố vào các lớp và phân lớp dựa theo năng lượng của chúng.
Các electron thuộc cùng một lớp có năng lượng gần bằng nhau.
Các electron thuộc cùng một phân lớp có năng lượng bằng nhau.
Câu 2. Khẳng định nào sau đây là đúng?
A. Các electron thuộc cùng một lớp có năng lượng bằng nhau, thuộc cùng một phân lớp có năng lượng gần bằng nhau;
B. Các electron thuộc cùng một lớp có năng lượng gần bằng nhau, thuộc cùng một phân lớp có năng lượng bằng nhau;
C. Các electron thuộc cùng một lớp, phân lớp đều có mức năng lượng bằng nhau;
D. Các electron thuộc cùng một lớp, phân lớp có mức năng lượng gần bằng nhau.
Đáp án: B
Giải thích:
Khẳng định đúng là:
Các electron thuộc cùng một lớp có năng lượng gần bằng nhau, thuộc cùng một phân lớp có năng lượng bằng nhau;
Câu 3. Số lượng AO trong lớp electron thứ n (n ≤ 4) là
A. 2n2
B. n2
C. 2n
D. 2n
Đáp án: B
Giải thích:
Trong lớp electron thứ n (n ≤ 4) có:
- Số AO là: n2
- Số electron tối đa là: 2n2
Câu 4. Ở lớp N có số AO là
A. 1;
B. 4;
C. 8;
D. 16.
Đáp án: D
Giải thích:
Trong lớp electron thứ n (n ≤ 4) có n2AO.
Lớp N là lớp thứ 4 nên có 42 = 16 (AO)
Câu 5. Số lượng AO trong các phân lớp ns; np; nd; nf lần lượt là
A. 1; 4; 9; 16
B. 1; 2; 3; 4
C. 1; 3; 5; 7
D. 2; 6; 10; 14
Đáp án: C
Giải thích:
Số lượng AO trong mỗi phân lớp
- Phân lớp ns có 1 AO;
- Phân lớp np có 3 AO;
- Phân lớp nd có 5 AO;
- Phân lớp ns có 7 AO;
Câu 6. Số electron tối đa trên mỗi phân lớp ns; np; nd; nf lần lượt là
A. 1; 4; 9; 16
B. 2; 8; 18; 32
C. 1; 3; 5; 7
D. 2; 6; 10; 14
Đáp án: D
Giải thích:
Mỗi AO chứa tối đa 2 electron
- Phân lớp ns có 1 AO nên có tối đa 2 electron
- Phân lớp np có 3 AO nên có tối đa 6 electron
- Phân lớp nd có 5 AO nên có tối đa 10 electron
- Phân lớp ns có 7 AO nên có tối đa 14 electron
Câu 7. Số phân lớp ở lớp eletron thứ n là
A. 2n2
B. n2
C. n
D. 2n
Đáp án: C
Giải thích: Lớp electron thứ n có n phân lớp và được kí hiệu lần lượt là ns, np, nd, nf, …
Câu 8. Khẳng định nào sau đây là sai?
Kí hiệu 2p5 cho biết
A. phân lớp 2p có 5 electron;
B. phân lớp này ở lớp L;
C. phân lớp này có 1 electron độc thân;
D. phân lớp 2p đã bão hòa.
Đáp án: D
Giải thích:
- Chỉ số phía trên bên phải kí hiệu phân lớp biểu diễn số electron trong phân lớp. Nên kí hiệu 2p5 cho biết phân lớp 2p có 5 electron. → Khẳng định A đúng
- Phân lớp 2p ở lớp thứ 2 có tên là lớp L. → Khẳng định B đúng
- Phân lớp 2p có 5 electron phân bố vào 3 AO, mỗi AO chứa tối đa 2 electron nên sẽ có 1 AO chỉ có 1 electron, electron đó gọi là electron độc thân. Do đó phân lớp này có 1 electron độc thân. → Khẳng định C đúng
- Phân lớp này chưa chứa đủ số electron tối đa (6 electron) nên chưa bão hòa. → Khẳng định D sai.
Câu 9. Lớp N có các phân lớp được kí hiệu lần lượt là
A. 3s, 3p, 3d;
B. 4s, 4p, 4d;
C. 4s, 4p, 4d, 4f;
D. 1s, 2s, 3s, 4s;
Đáp án: C
Giải thích: Lớp N là lớp electron thứ 4 nên có 4 phân lớp, được kí hiệu là 4s, 4p, 4d và 4f.
Câu 10. Nguyên tử X có cấu hình electron 1s2 2s2 2p6 3s2 3p4. Khẳng định sai là
A. Nguyên tử X có 16 electron;
B. Phân lớp 3p của nguyên tử X chưa bão hòa;
C. Nguyên tử X có 6 electron ở lớp ngoài cùng;
D. Nguyên tử X có 4 lớp electron.
Đáp án: D
Giải thích:
Tổng số electron trên các phân lớp là 2 + 2 + 6 + 2 + 4 = 16 (electron) nên nguyên tử X có 16 electron. → Khẳng định A đúng
Phân lớp 3p có 4 electron chưa đủ số electron tối đa (6 electron) nên phân lớp 3p chưa bão hòa. → Khẳng định B đúng
Lớp ngoài cùng là lớp thứ 3 có tổng số electron là 2 + 4 = 6 (electron) nên nguyên tử X có 6 electron ở lớp ngoài cùng. → Khẳng định C đúng
Lớp ngoài cùng là lớp thứ 3 nên nguyên tử X có 3 lớp electron. → Khẳng định D sai.
Câu 11. Cho nguyên tử Mn có Z = 25. Cấu hình electron của nguyên tử Mn là
A. 1s2 2s2 2p6 3s2 3p6 3d7
B. 1s2 2s2 2p6 3s2 3p6 4d7
C. 1s2 2s2 2p6 3s2 3p6 4s2 3d5
D. 1s2 2s2 2p6 3s2 3p6 3d5 4s2
Đáp án: D
Giải thích:
Nguyên tử Mn có Z = 25.
Điền 25 electron vào dãy Klechkovski theo quy tắc ta được dãy:
1s2 2s2 2p6 3s2 3p6 4s2 3d5
Sắp xếp lại vị trí của phân lớp 4s2 và 3d5 theo quy tắc ta được cấu hình electron là:
1s2 2s2 2p6 3s2 3p6 3d5 4s2
Câu 12. Nguyên tử N có Z = 7. Số electron độc thân trong nguyên tử N là
A. 7
B. 5
C. 3
D. 1
Đáp án: C
Giải thích:
Cấu hình electron nguyên tử của N là: 1s2 2s2 2p3
Cấu hình theo ô orbital của N là:
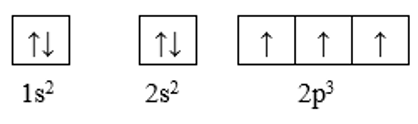
Như vậy nguyên tử N có 3 electron độc thân thuộc AO 2p.
Câu 13. Cho các phát biểu sau
(a) Orbital 1s có dạng hình cầu, orbital 2s có dạng hình số tám nổi;
(b) Trong một nguyên tử, năng lượng của electron thuộc AO 1s thấp hơn năng lượng của electron thuộc AO 2s;
(c) Trong một nguyên tử, năng lượng của electron thuộc AO 2s thấp hơn năng lượng của electron thuộc AO 2p;
(d) Trong một nguyên tử, năng lượng của electron thuộc AO 2s gần bằng năng lượng của electron thuộc AO 2p;
Những phát biểu đúng là
A. (a), (d)
B. (b), (c)
C. (b), (d)
D. (a), (c)
Đáp án: C
Giải thích:
(a) Orbital 1s có dạng hình cầu, orbital 2s có dạng hình số tám nổi ⇒ Sai vì orbital 2s có dạng hình cầu.
(b) Trong một nguyên tử, năng lượng của electron thuộc AO 1s thấp hơn năng lượng của electron thuộc AO 2s ⇒ Đúng vì electron thuộc AO 1s ở lớp thứ nhất gần hạt nhân hơn so với electron thuộc AO 2s ở lớp thứ hai nên có mức năng lượng thấp hơn.
(c) Trong một nguyên tử, năng lượng của electron thuộc AO 2s thấp hơn năng lượng của electron thuộc AO 2p ⇒ Sai vì electron thuộc AO 2s và 2p thuộc cùng lớp thứ 2 mà các electron trong cùng một lớp có mức năng lượng gần bằng nhau.
(d) Trong một nguyên tử, năng lượng của electron thuộc AO 2s gần bằng năng lượng của electron thuộc AO 2p ⇒ Đúng.
Câu 14. Cho nguyên tử Ca có Z = 20. Nguyên tử Ca nhường 2 electron để trở thành ion Ca2+. Biết cấu hình electron của ion được thiết lập bằng cách nhận hoặc nhường electron bắt đầu từ phân lớp ngoài cùng của cấu hình electron nguyên tử tương ứng.
A. 1s2 2s2 2p6 3s2 3p6 4s2
B. 1s2 2s2 2p6 3s2 3p6 4s2 4p2
C. 1s2 2s2 2p6 3s2 3p6
D. 2s2 2p6 3s2 3p6 4s2
Đáp án: C
Giải thích:
Cấu hình electron nguyên tử của Ca có Z = 20 là: 1s2 2s2 2p6 3s2 3p6 4s2
Để trở thành ion Ca2+ nguyên tử Ca nhường 2 electron ở phân lớp ngoài cùng là phân lớp 4s2.
Do đó cấu hình electron của ion Ca2+ là: 1s2 2s2 2p6 3s2 3p6
Câu 15. Tính chất hóa học đặc trưng của nguyên tử được quyết định bởi các electron lớp ngoài cùng. Các nguyên tử có 1, 2 hoặc 3 electron ở lớp ngoài cùng thường là
A. các nguyên tử của nguyên tố phi kim;
B. các nguyên tử của nguyên tố kim loại;
C. các nguyên tử của nguyên tố khí hiếm;
D. các nguyên tử của nguyên tố thuộc nhóm halogen.
Đáp án: B
Giải thích:
Tính chất hóa học đặc trưng của nguyên tử được quyết định bởi các electron lớp ngoài cùng. Từ cấu hình electron nguyên tử ta có thể dự đoán được tính chất theo quy tắc:
- Các nguyên tử có 1, 2 hoặc 3 electron ở lớp ngoài cùng thường là các nguyên tử của nguyên tố kim loại.
- Các nguyên tử có 5, 6 hoặc 7 electron ở lớp ngoài cùng thường là các nguyên tử của nguyên tố phi kim.
- Các nguyên tử có 8 electron ở lớp ngoài cùng (trừ He chỉ có 2 electron) là các nguyên tử của nguyên tố khí hiếm.
- Các nguyên tử có 4 electron ở lớp ngoài cùng thì có thể là nguyên tử của nguyên tố kim loại hoặc phi kim.
Các câu hỏi trắc nghiệm Hoá học lớp 10 sách Cánh diều có đáp án, chọn lọc khác:
Trắc nghiệm Bài 6: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Trắc nghiệm Bài 8: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Trắc nghiệm Bài 9: Quy tắc octet
Trắc nghiệm Bài 10: Liên kết ion
Xem thêm các chương trình khác:
- Trắc nghiệm Toán lớp 10 có đáp án – Kết nối tri thức
- Trắc nghiệm Hóa học lớp 10 có đáp án – Kết nối tri thức
- Trắc nghiệm Địa Lí lớp 10 có đáp án – Kết nối tri thức
- Trắc nghiệm Công nghệ lớp 10 có đáp án – Kết nối tri thức
- Trắc nghiệm Giáo Dục Quốc Phòng lớp 10 có đáp án – Kết nối tri thức
- Trắc nghiệm Vật Lí lớp 10 có đáp án – Kết nối tri thức
- Trắc nghiệm Lịch sử lớp 10 có đáp án - Kết nối tri thức
- Trắc nghiệm Sinh học lớp 10 có đáp án – Kết nối tri thức
- Trắc nghiệm Tin học lớp 10 có đáp án - Kết nối tri thức
- Trắc nghiệm Kinh tế pháp luật lớp 10 có đáp án - Kết nối tri thức
- Trắc nghiệm Tiếng Anh lớp 10 có đáp án - Global Success Kết nối tri thức
- Trắc nghiệm Toán lớp 10 có đáp án – Chân trời sáng tạo
- Trắc nghiệm Địa Lí lớp 10 có đáp án – Chân trời sáng tạo
- Trắc nghiệm GDTC lớp 10 có đáp án – Chân trời sáng tạo
